









 Рейтинг: 5.0/5.0 (1877 проголосовавших)
Рейтинг: 5.0/5.0 (1877 проголосовавших)Категория: Инструкции

Фармакодинамика. Тенофовира дизопроксила фумарат in vivo превращается в тенофовир, аналог нуклеозидмонофосфата (нуклеотида) аденозина монофосфата. Тенофовир в последующем превращается в активный метаболит - тенофовира дифосфат. Тенофовир - нуклеотидный ингибитор обратной транскриптазы обладает специфичной активностью по отношению к вирусу иммунодефицита человека (ВИЧ-1 и ВИЧ-2), и вирусу гепатита В. Тенофовира дифосфат ингибируют обратную транскриптазу ВИЧ-1 и полимеразу вируса гепатита 8 по конкурентному механизму, результатом чего является терминация синтеза цепи ДНК. Тенофовира дифосфат является слабым ингибитором ДНК-полимераз млекопитающих. В тестах in vitro тенофовир в концентрациях до 300 мкмоль/л не оказывал влияния на синтез митохондриальной ДНК и образование молочной кислоты. Противовирусная активность. Противовирусная активность в отношении ВИЧ. Противовирусная активность тенофовира в отношении лабораторных и донорских штаммов ВИЧ-1 оценивалась на линиях лимфобластоидных клеток, первичных моноцитах/макрофагах и лимфоцитах периферической крови. Показатель эффективной концентрации тенофовира находился в диапазоне от 0,04 до 8,5 мкмоль. В культуре клеток тенофовир показал противовирусное действие в отношении ВИЧ-1 подтипов А, В, С, D, Е, F, G, О (эффективная концентрация находилась в диапазоне от 0,5 до 2,2 мкмоль), а также угнетающее действие на некоторые штаммы ВИЧ-2 (эффективная концентрация находилась в диапазоне от 1.6 мкмоль до 5,5 мкмоль). При использовании тенофовира in vitro отмечался синергизм противовирусной активности препаратов. В исследованиях комбинированного применения препарата с ингибиторами протеаз ВИЧ и с нуклеозидными и ненуклеозидными аналогами ингибиторов обратной транскриптазы ВИЧ-1 отмечались аддитивные или синергические эффекты. Противовирусная активность в отношении вируса гепатита В. Противовирусную активность тенофовира в отношении вируса гепатита В оценивали на линии клеток HepG2 2.2.15. Показатель эффективной концентрации тенофовира находился в диапазоне 0,14 до 1,5 мкмоль при эффективной цитотоксической концентрации >100 мкмоль. В культурах клеток исследования противовирусной активности комбинаций тенофовира с нуклеозидными ингибиторами обратных транскриптаз, действующих на вирус гепатита В (эмтрицитабин, энтекавир, ламивудин и телбивудин) не обнаружено антагонизма активностей препаратов. Резистентность. Резистентность при ВИЧ-1. Штаммы ВИЧ-1, со сниженной чувствительностью ктенофовиру и K65R мутации в обратной транскриптазе были получены in vitro и у некоторых пациентов. Применение тенофовира дизопроксила фумарата следует избегать пациентам со штаммами мутаций K65R, ранее получавшим антиретровирусную терапию. Резистентность при гепатите В. Мутаций вируса гепатита В, связанных с резистентностью ктенофовиру, выявлено не было. Фармакокинетика. Всасывание. После перорального приема у ВИЧ-инфицированных больных тенофовира дизопроксила фумарат быстро всасывается и превращается в тенофовир. Cmax тенофовира в сыворотке крови наблюдались через час после приема натощак и через 2 ч после приема с пищей. Биодоступность тенофовира из тенофовира дизопроксила фумарата после приема внутрь натощак составляла приблизительно 25%. В результате приема тенофовира дизопроксила фумарата с пищей увеличивалась биодоступность при пероральном приеме, при этом AUC и средняя максимальная концентрация тенофовира возрастали приблизительно на 40% и 14%. После первого приема тенофовира дизопроксила фумарата с пищей максимальная концентрация в сыворотке крови составляет от 213 до 375 мг/мл. Распределение. Vd при равновесном состоянии после внутривенного введения тенофовира приблизительно оценивался в 800 мл/кг. При концентрациях тенофовира от 0,01 до 25 мкг/мл связывание тенофовира с белками плазмы и сыворотки in vitro было меньше 0.7% и 7.2%, соответственно. Метаболизм. В исследованиях in vitro было установлено, что ни тенофовира дизопроксила фумарат, ни тенофовир не являются субстратами изоферментов цитохрома Р450. Более того, при концентрациях, значительно (приблизительно в 300 раз) превышавших концентрации препарата, наблюдавшиеся in vivo, тенофовир в условиях in vitro не ингибировал метаболизм, который протекает с участием основных изоферментов цитохрома Р450 человека (CYP3A4, CYP2D6, CYP2C9, CYP2E1 или CYP1A1/2). Тенофовира дизопроксила фумарат не влиял на какие-либо изоферменты цитохрома Р450, за исключением CYP1A1/2 (отмечалось небольшое (6%), но статистически значимое уменьшение метаболизма субстрата цитохрома CYP1A1/2). Выведение. Выведение тенофовира главным образом происходит через почки посредством фильтрации и системы активного канальцевого транспорта. Линейность/нелинейность. Фармакокинетика тенофовира не зависела от дозы тенофовира дизопроксила фумарата (при дозе от 75 до 600 мг); многократный прием препарата в любой дозе также не влиял на фармакокинетику тенофовира. Фармакокинетика в особых популяциях. Ограниченные данные по фармакокинетике тенофовира у женщин указывают на отсутствие существенных половых различий. Не проводилось исследований фармакокинетики с участием детей, подростков до 18 лет и пожилых людей старше 65 лет. Специальных исследований фармакокинетики в разных этнических группах не проводилось.

Со стороны желудочно-кишечного тракта: диарея, рвота, тошнота, метеоризм, панкреатит, повышение активности амилазы, боль в животе, вздутие. Со стороны нервной системы: головокружение, головная боль, депрессия. Со стороны иммунной системы: аллергические реакции, в т.ч. ангионевротический отек. Со стороны обмена веществ: гипофосфатемия, лактацидоз, гипокалиемия. Со стороны дыхательной системы: одышка. Со стороны печени и желчевыводящих путей: жировая дистрофия печени, повышение активности печеночных ферментов (чаще всего ACT, АЛТ, ГГТ), гепатит. Со стороны кожи и подкожно-жировой клетчатки: сыпь. Со стороны опорно-двигательной системы и соединительной ткани: рабдомиолиз, остеомаляция (чаще проявляется болью в костях, изредка приводит к переломам), мышечная слабость, миопатия. Со стороны почек и мочевыводящих путей: нарушения функции почек, в т.ч. острые, почечная недостаточность, острый некроз канальцев почек, синдром Фанкони, почечная тубулопатия проксимального типа, интерстициальный нефрит (включая случаи острого нефрита), повышение концентрации креатинина, протеинурия, полиурия, нефрогенный несахарный диабет. Прочие: утомляемость, астения.
Обновлено 26.09.2013 15:21
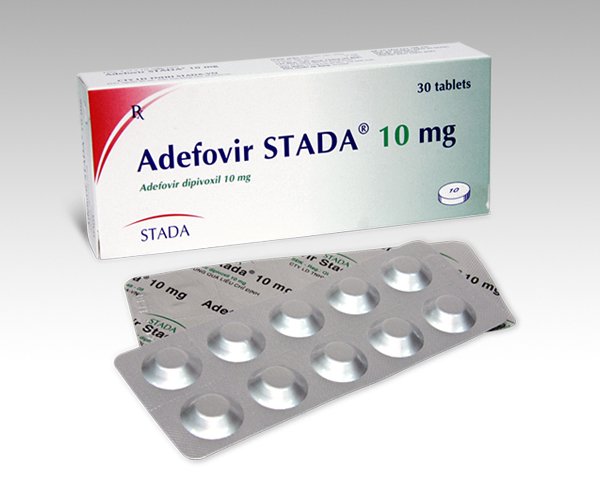
Адефовир Hepsera ®
(adefovir dipivoxil)
Гепсера - адефовира дипивоксил в таблетках
Информация для врачей
ВНИМАНИЕ.
Есть сообщения о случаях развития тяжелых обострений гепатита у пациентов, прекративших прием препаратов для лечения гепатита в. в том числе и после прекращения приема HEPSERA. после отмены HEPSERA необходимо периодически контролировать функцию печени. в некоторых случаях может быть оправдано возобновление лечения противогепатитными препаратами.У пациентов с сопутствующей патологией п очек или с повышенным риском нарушения функции почек длительный прием HEPSERA может приводить к нефротоксическому эффекту. у таких пациентов необходимо тщательно контролировать функцию почек, так как может потребоваться корректировка дозы (см. меры предосторожности, способ применения и дозы).
Применение препаратов для лечения гепатита в, обладающих противовирусной активностью в отношении вич (к таким препаратам относится и HEPSERA), у пациентов с нераспознанной или нелеченной вич-инфекцией может привести к развитию лекарственной устойчивости вируса иммунодефицита человека.
Есть сообщения о случаях развития молочнокислого ацидоза и выраженной гепатоспленомегалии со стеатозом, в том числе и с летальным исходом, при монотерапии аналогами нуклеозидов или в комбинации с другими антиретровирусными средствами (см. меры предосторожности).
ОПИСАНИЕ
HEPSERA - торговое название адефовира дипивоксила, диэстерифицированного предшественника адефовира. Адефовир является ациклическим аналогом нуклеотидов, активным в отношении человеческого вируса гепатита В (HBV).
Химическое название адефовира дипивоксила: 9-[2-[бис[(пивалойлокси)метокси]фосфинил]метокси]этил]аденин. Молекулярная формула C20H32N5O8P. Молекулярный вес 501,48
Адефовира дипивоксил представляет собой кристаллический порошок белого или желтоватого цвета. Растворимость в воде при рН 2,0 составляет19 мг/мл, а при рН = 7,2 растворимость равна 0,4 мг/мл. Коэффициент распределения (log p) адефовира дипивоксила в октанол/водном фосфатном буфере (рН=7) составляет 1,91.
Таблетки HEPSERA предназначены для орального применения. В каждой таблетке содержится 10 мг адефовира дипивоксила, а также следующие неактивные ингредиенты: кроскармеллоза натрия, лактозы моногидрат, магния стеарат, прежелатинизированный крахмал и тальк.
Микробиология
Механизм действия:
Адефовир является ациклическим аналогом аденозина монофосфата. Адефовир фосфорилируется под действием клеточных киназ в активный метаболит, адефовира дифосфат. Адефовира дифосфат ингибирует ДНК-полимеразу вируса гепатита В (обратную транскриптазу) конкурируя с естественным субстратом дезоксиаденозина трифосфатом и вызывая обрыв цепи ДНК после его инкорпорации в вирусную ДНК. Константа ингибирования (Кi) ДНК-полимеразы вируса гепатита В для адефовира дифосфата равна 0,1 ммоль. Адефовира дифосфат является слабым ингибитором человеческих ДНК-полимераз. и. со значениями Кi 1,18 ммоль и 0,97 ммоль соответственно.
Противовирусная активность:
Установлена противовирусная активность адефовира in vitro в линиях клеток гепатомы человека, трансфицированных вирусом гепатита В. Концентрация адефовира, которая ингибировала 50% синтеза вирусной ДНК (IC50) варьировала от 0,2 до 2,5 ммоль.
Лекарственная устойчивость
Клинические исследования 437 и 438
Генотипический и фенотипический анализ сывороточной ДНК вируса гепатита В у HBeAg-положительных пациентов (n=215, исследование 437), и у HBeAg-отрицательных пациентов (n=56, исследование 438), принимавших адефовира дипивоксил (10 мг или 30 мг), до начала лечения и на 48 неделе лечения, не было выявлено мутаций гена HBV ДНК-полимеразы, которые могли бы приводить к снижению восприимчивости к адефовиру. У некоторых пациентов наблюдалось неподтвержденное увеличение ДНК HBV в сыворотке крови ?1 log10 ДНК-копий/мл. Молекулярная основа и/или клиническое значение наблюдавшегося неподтвержденного увеличения количества ДНК-копий не известны.
Перекрестная устойчивость:
Рекомбинантные варианты HBV, содержащие в гене ДНК полимеразы мутации, связанные с устойчивостью к ламивудину (L528M, M552I, M552V, L528M+M552V), были чувствительны к адефовиру in vitro. Также была продемонстрирована противовирусная активность адефовира в отношении клинических изолятов HBV, содержащих мутации, связанные с резистентностью к ламивудину (среднее снижение сывороточной ДНК HBV - 4,3 log10 ДНК-копий/мл) (исследование 435). Варианты HBV с T476N и R или W501Q мутациями ДНК полимеразы, связанными с резистентностью к иммуноглобулину гепатита В, были чувствительны к адефовиру in vitro.
КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ
Фармакокинетика
Фармакокинетика адефовира была оценена на здоровых добровольцах и на пациентах с хроническим гепатитом В. Фармакокинетика препарата оказалась одинаковой для обеих групп.
Всасывание
Адефовира дипивоксил является диэстерифицированным предшественником активной части адефовира. На основании данных перекрестного исследования было установлено, что при однократном оральном приеме HEPSERA в дозе 10 мг биодоступность адефовира составляет приблизительно 59%.
После однократного приема 10 мг HEPSERA у пациентов с хроническим гепатитом В (n = 14) пиковая концентрация адефовира в плазме (Cmax) была равна 18,4 ± 6,26 нг/мл (среднее значение ± стандартное отклонение), время достижения пиковой концентрации варьировало от 0,58 до 4,00 часов (медиана = 1,75 часа) после приема препарата. Площадь под кривой "концентрация в плазме - время" (ППК 0-?) для адефовира была равна 220 ± 70,0 нг*час/мл. Концентрация адефовира в плазме снижалась биэкспоненциально, окончательный период полувыведения был равен 7,48 ± 1,65 часа.
Фармакокинетика адефовира у людей с нормальной функцией почек не изменялась при приеме 10 мг HEPSERA один раз в день на протяжении 7 дней. Влияние длительного приема HEPSERA в ежедневной дозе 10 мг однократно на фармакокинетику адефовира не исследовалось.
Влияние пищи на всасывание лекарства
Воздействие адефовира не изменялось при однократном приеме 10 мг HEPSERA вместе с пищей (пища с высоким содержанием жиров энергетической ценностью около 1000 ккал). HEPSERA можно принимать вне зависимости от приема пищи.
Распределение
In vitro связывание адефовира с плазмой человека или с сывороточными белками человека составляет. 4% при концентрации адефовира в пределах от 0,1 до 25 мг/мл. Объем распределения в стационарном состоянии после внутривенного введения препарата в дозе 1,0 или 3,0 мг/кг/день составляет 392 ± 75 мл/кг и 352 ± 9 мл/кг соответственно.
Метаболизм и выведение
После перорального приема адефовира дипивоксил быстро превращается в адефовир. Сорок пять процентов дозы препарата выводится с мочой в виде адефовира на протяжении 24 часов после приема HEPSERA в дозе 10 мг. Экскреция адефовира почками осуществляется с помощью комбинации клубочковой фильтрации и активной канальцевой секреции (см. лекарственные взаимодействия).
Особые группы пациентов
Пол
Фармакокинетика адефовира была одинаковой у мужчин и у женщин.
Раса
Данных недостаточно для определения влияния расовой принадлежности на фармакокинетику адефовира.
Дети и пожилые пациенты
Исследования фармакокинетики у детей и пожилых людей не проводились.
Поражение почек
У лиц с умеренными или тяжелыми нарушениями функции почек или у пациентов в терминальной стадии почечной недостаточности, нуждающихся в гемодиализе, значение Cmax, площадь под кривой "концентрация-время" (ППК0-?) и период полувыведения (Т1/2) были увеличены по сравнению с людьми с нормальной почечной функцией. У таких пациентов рекомендуется корректировать интервал между приемами HEPSERA (см. СПОСОБ ПРИМЕНЕНИЯ И ДОЗЫ).
Фармакокинетика адефовира у пациентов с разной степенью нарушения почечной функции, не страдающих хроническим гепатитом В, приведена в Таблице 1. В этом исследовании пациенты получали HEPSERA в дозе 10 мг один раз в день.
Таблица 1.Фармакокинетические параметры адефовира (среднее значение ± стандартное отклонение) у пациентов с различной степенью нарушения функции почек.
При четырехчасовом гемодиализе удалялось около 35% дозы адефовира. Влияние перитонеального диализа на элиминацию адефовира не изучалось.
Поражение печени
 Была исследована фармакокинетика адефовира у пациентов с нарушением функции печени, не страдающих хроническим гепатитом В, после однократного приема 10 мг HEPSERA. У пациентов с умеренным и выраженным нарушением функции печени не было существенных изменений фармакокинетики адефовира по сравнению с пациентами без нарушения печеночной функции. Пациенты с нарушением функции печени могут принимать HEPSERA в обычной дозировке.
Была исследована фармакокинетика адефовира у пациентов с нарушением функции печени, не страдающих хроническим гепатитом В, после однократного приема 10 мг HEPSERA. У пациентов с умеренным и выраженным нарушением функции печени не было существенных изменений фармакокинетики адефовира по сравнению с пациентами без нарушения печеночной функции. Пациенты с нарушением функции печени могут принимать HEPSERA в обычной дозировке.
Лекарственное взаимодействие
Адефовира дипивоксил in vivo быстро превращается в адефовир. В концентрациях значительно выше (более чем в 4000 раз), чем наблюдающиеся in vivo, адефовир не ингибирует ни один из ферментов CYP450, CYP1A2, V2C9, CYP2C19, CYP2D6 и CYP3A4. Адефовир не является субстратом для этих ферментов. Однако возможность адефовира индуцировать ферменты CYP450 не изучена. На основании результатов данных in vitro экспериментов и с учетом почечного пути выведения адефовира, можно сделать заключение о низкой вероятности CYP450 опосредованных взаимодействий с участием адефовира в качестве ингибитора или субстрата с другими медицинскими препаратами.
Была оценена фармакокинетика адефовира после многократного назначения HEPSERA (10 мг один раз в день) в комбинации с ламивудином (100 мг один раз в день), триметоприм/сульфаметоксазолом (160/800 мг два раза в день), ацетаминофеном (1000 мг четыре раза в день) и ибупрофеном (800 мг три раза в день) на здоровых добровольцах (n = 18 в каждом исследовании).
Адефовир не нарушал фармакокинетику ламивудина, триметоприм/сульфаметоксазола, ацетаминофена и ибупрофена.
Фармакокинетика адефовира не изменялась при совместном приеме HEPSERA с ламивудином, триметоприм/сульфаметоксазолом и ацетаминофеном. При одновременном назначении HEPSERA с ибупрофеном (800 мг три раза в день) было отмечено повышение Cmax адефовира (33%), ППК (23%) и выведения препарата с мочой. Данные изменения, вероятнее всего, связаны с более высокой биодоступностью при приеме внутрь, а не с уменьшением почечного клиренса адефовира.
ПОКАЗАНИЯ И ПРИМЕНЕНИЕ
HEPSERA показан для лечения хронического гепатита В у взрослых с признаками активной репликации вируса и либо с персистирующими повышениями уровня сывороточных аминотрансфераз (АЛТ или АСТ ), либо с гистологическими признаками активности заболевания.
Данное показание основано на гистологическом, вирологическом, биохимическом и серологическом ответах у взрослых пациентов с HBeAg+ и HBeAg- хроническими гепатитами с компенсированной функцией печени и у пациентов с клиническими признаками ламивудин-резистентного гепатита В как с компенсированной, так и с декомпенсированной печеночной функцией.
Описание клинических исследований
HBeAg-положительный хронический гепатит В:
Исследование 437 представляло собой рандомизированное двойное слепое плацебо-контролируемое с тремя параллельными группами исследование, в котором участвовали пациенты с HBeAg-положительным хроническим гепатитом В. Данное исследование позволило сравнить HEPSERA и плацебо. Средний возраст пациентов был 33 года. 74% пациентов были мужчины, 59% - уроженцы Азии, 36% были европейцы, а 24% ранее получали лечение альфа-интерфероном. До начала лечения средний общий гистологический индекс активности (по Knodell) составлял 10, средний уровень ДНК HBV в сыворотке крови, измеренный с помощью полимеразной цепной реакции, был равен 8,36 log10 копий/мл, а средний уровень АЛТ в 2,3 раза превышал верхнюю границу нормы.
HBeAg-отрицательный (anti-HBe положительный/НBV ДНК положительный) хронический гепатит В:
Исследование 438 представляло собой рандомизированное двойное слепое плацебо-контролируемое исследование с участием пациентов, которые были HBeAg-негативными и anti-HВe позитивными при скрининге. Средний возраст пациентов был равен 46 годам. 83% были мужчины, 66% были европейцы, 30% были азиаты, и 41% ранее получали лечение ?-интерфероном. До начала лечения средний общий гистологический индекс активности (по Knodell) составлял 10, средний уровень ДНК HBV в сыворотке крови, измеренный с помощью полимеразной цепной реакции, был равен 7,08 log10 копий/мл, а средний уровень АЛТ в 2,3 раза превышал верхнюю границу нормы.
Первичной конечной точкой эффективности в обоих исследованиях являлось гистологическое улучшение на 48 неделе. Результаты гистологического исследования показаны в Таблице 2.
Таблица 2. Гистологический ответ на 48 неделе*
* у пациентов с HBeAG-негативным гепатитом не может быть сероконверсии HBeAG.
В исследованиях 437 и 438 при продолжении лечения HEPSERA до 72 недель концентрация сывороточной ДНК HBV продолжала снижаться. Увеличение доли пациентов с нормализацией АЛТ также отмечалось в исследовании 437. Влияние продолжающегося лечения с помощью HEPSERA на сероконверсию не известно.
Пациенты до и после трансплантации печени
Кроме того, было проведено открытое неконтролируемое исследование (исследование 435) 324 пациентов с хроническим гепатитом В и с клиническими признаками ламивудин-резистентного гепатита В до (n = 128) и после (n = 196) трансплантации печени. У пациентов до и после трансплантации печени среднее значение ДНК HBV, определенное с помощью ПЦР, составило 7,4 и 8,2 log10 копий/мл, а средний исходный уровень АЛТ был в 1,8 и 2,1 раза выше верхней границы нормы соответственно. Результаты этого исследования показаны в Таблице 5. Лечение с помощью HEPSERA привело к одинаковому снижению сывороточной ДНК HBV, вне зависимости от характера мутаций ламивудин-резистентной ДНК HBV полимеразы до лечения. Клиническое значение этих открытий и их связь с гистологическим улучшением неизвестны.
Таблица 5. Эффективность у пациентов до и после трансплантации печени на 48 неделе лечения
До трансплантации печени
После трансплантации печени
Среднее изменение ± стандартное отклонение сывороточной ДНК HBV по сравнению с исходной (log10 копий/мл)
Стабильная оценка или улучшение по шкале Child-Pugh-Turcotte
* Данные 24 недели
** по отношению к пациентам, у которых до начала лечения эти параметры отклонялись от нормы.
Клинические признаки резистентности к ламивудину
В продолжающемся исследовании 461 (двойное слепое активно контролируемое исследование с участием 59 пациентов с хроническим гепатитом В с клиническими признаками резистентности вируса к ламивудину) пациенты были рандомизированы для назначения либо монотерапии HEPSERA, либо HEPSERA в комбинации с ламивудином 100 мг, либо монотерапии ламивудином. На 16 неделе снижение сывороточной ДНК HBV (среднее значение ± стандартное отклонение), измеренное с помощью ПЦР, составило 3,11 ± 0,94 log10 копий/мл для пациентов, получавших HEPSERA, и 2,95 ± 0,64 log10 копий/мл для пациентов, получавших HEPSERA в комбинации с ламивудином. У пациентов, получавших только ламивудин, среднее снижение ДНК HBV в сыворотке крови составило 0,00 ± 0,28 log10 копий/мл. Клиническое значение зафиксированных изменений уровня сывороточной ДНК HBV еще не установлено.
ПРОТИВОПОКАЗАНИЯ
HEPSERA противопоказан пациентам с гиперчувствительностью к любому из компонентов препарата.
МЕРЫ ПРЕДОСТОРОЖНОСТИ
Обострения гепатита после прекращения лечения
Есть сообщения о случаях тяжелого обострения гепатита у пациентов, прекративших прием препаратов для лечения гепатита В, в том числе и после прекращения приема HEPSERA. После прекращения приема HEPSERA необходимо периодически проверять функцию печени. В некоторых случаях может быть оправдано возобновление лечения противогепатитными препаратами.
В клинических испытаниях HEPSERA обострение гепатита (подъем АЛТ до уровня, превышающего верхнюю границу нормы в 10 раз, или еще выше) отмечалось приблизительно у 25% пациентов после окончания приема HEPSERA. В большинстве случаев обострение развивалось в течение первых 12 недель после отмены препарата. Обострения гепатита наблюдались, главным образом, в тех случаях, когда не было HBeAg сероконверсии, и проявлялись в виде повышения уровня АЛТ в сыворотке в сочетании с возобновлением репликации вируса. В HВeAg-позитивных и HВeAg-негативных исследованиях с участием пациентов с компенсированной функцией печени, обострения в основном не сопровождались декомпенсацией печеночной функции. Однако у пациентов с запущенными заболеваниями печени или циррозом риск печеночной декомпенсации может увеличиваться. Хотя в большинстве случаев обострение гепатита не требовало лечения или разрешалось после возобновления приема препарата, есть сообщения о тяжелых обострениях гепатита, в том числе и с летальным исходом. По этой причине необходимо внимательно наблюдать за пациентами после прекращения приема препарата.
Нефротоксичность
Нефротоксичность, проявляющаяся постепенным повышением креатинина и снижением фосфора в сыворотке крови, была фактором, ограничивающим применение адефовира дипивоксила в значительно более высоких дозах у ВИЧ-инфицированных пациентов (60 и 120 мг в день) и у пациентов с хроническим гепатитом В (30 мг в день). При длительном приеме HEPSERA (10 мг в день однократно) может проявляться нефротоксический эффект препарата. В целом у пациентов с адекватной функцией почек риск нефротоксического действия низкий. Однако риск нефротоксического действия возрастает у пациентов с нарушенной функцией почек и у пациентов, одновременно принимающих другие нефротоксические препараты, например, циклоспорин, такролимус, аминогликозиды, ванкомицин и нестероидные противовоспалительные препараты (см. ПОБОЧНЫЕ ЭФФЕКТЫ).
Необходимо контролировать функцию почек у всех пациентов, принимающих HEPSERA, особенно тщательно нужно следить за пациентами с заболеваниями почек в анамнезе и за пациентами с повышенным риском нарушения почечной функции. Пациентам с признаками почечной недостаточности присутствовавшими еще до начала лечения или появившимися во время приема препарата, может потребоваться корректировка дозы (см. СПОСОБ ПРИМЕНЕНИЯ И ДОЗЫ). Перед тем, как отменить прием HEPSERA у пациента с развившейся на фоне лечения нефротоксичностью, необходимо тщательно взвесить риск и пользу терапии препаратом HEPSERA.
Устойчивость вируса иммунодефицита человека
Перед началом лечения препаратом HEPSERA всем пациентам необходимо предложить сделать анализ на антитела к ВИЧ. Применение препаратов для лечения гепатита В, обладающих противовирусной активностью в отношении ВИЧ (к таким препаратам относится и HEPSERA), у пациентов с нераспознанной или нелеченной ВИЧ-инфекцией может привести к развитию лекарственной устойчивости вируса иммунодефицита человека. Активность HEPSERA в отношении подавления РНК ВИЧ у пациентов не подтверждена, однако, имеются ограниченные данные о применении HEPSERA для лечения пациентов с хроническим гепатитом В, коинфицированных ВИЧ.
Молочнокислый ацидоз / тяжелая гепатомегалия со стеатозом
Есть сообщения о случаях развития молочнокислого ацидоза и тяжелой гепатомегалии со стеатозом, в том числе с летальным исходом, при применении аналогов нуклеозидов в качестве монотерапии или в комбинации с антиретровирусными средствами.
В большинстве случаев эти осложнения развивались у женщин. Факторами риска могут быть избыточный вес и длительное воздействие нуклеозидов. Особую осторожность следует соблюдать при назначении аналогов нуклеозидов пациентам, у которых есть факторы риска развития поражения печени. Однако есть сообщения о развитии вышеперечисленных осложнений у пациентов, не имеющих известных факторов риска поражения печени. Лечение HEPSERA следует временно прекратить, если у пациента появляются клинические или лабораторные признаки молочнокислого ацидоза или явные признаки гепатотоксичности, которая может проявляться в виде гепатомегалии и стеатоза даже в отсутствие заметного повышения уровня трансаминаз.
МЕРЫ ПРЕДОСТОРОЖНОСТИ
Лекарственное взаимодействие
Так как адефовир выводится почками, то одновременное назначение HEPSERA и препаратов, снижающих функцию почек или конкурирующих с HEPSERA в процессе активной канальцевой секреции, может приводить к увеличению концентрации адефовира и/или вышеупомянутых препаратов в сыворотке крови.
За исключением ламивудина, триметоприм/сульфаметоксазола и ацетаминофена, отсутствуют данные о результатах одновременного назначения HEPSERA и лекарств, выводящихися через почки, или других лекарств, влияющих на функцию почек (см. КЛИНИЧЕСКУЮ ФАРМАКОЛОГИЮ).
Необходимо тщательно следить за возможными признаками побочных эффектов при одновременном назначении HEPSERA и лекарств, выводящихся почками, или других лекарств, влияющих на функцию почек.
Прием ибупрофена в дозе 800 мг три раза в день усиливал действие адефовира приблизительно на 23%. Клиническое значение данного усиления действия адефовира неизвестно (см. КЛИНИЧЕСКУЮ ФАРМАКОЛОГИЮ).
Адефовир не вызывает угнетения ферментов цитохрома CYP450, однако нет данных о том, может ли адефовир индуцировать ферменты CYP450.
Нет данных о влиянии адефовира на концентрации циклоспорина и такролимуса.
Продолжительность лечения.
Неизвестна оптимальная продолжительность лечения препаратом HEPSERA, а также связь между ответом на терапию и отдаленными результатами (в том числе развитие печеночно-клеточной карциномы или декомпенсированного цирроза печени).
Токсикологические исследования на животных
Тубулярная нефропатия, для которой характерно наличие гистологических изменений и/или увеличение азота мочевины крови и концентрации креатинина в сыворотке крови, была первым проявлением токсичности при повышении дозы адефовира дипивоксила при испытаниях на животных. Нефротоксичность была отмечена у животных при системном воздействии препарата, приблизительно в 3-10 раз превышающем воздействие препарата у человека при приеме рекомендуемой терапевтической дозы 10 мг в день.
Онкогенность, мутагенность, нарушение детородной функции
Были проведены исследования канцерогенного действия адефовира у мышей и крыс. Исследование препарата на мышах в дозах 1, 3 и 10 мг/кг/день не выявило связанного с лечением увеличения частоты опухолевых заболеваний при дозировке 10 мг/кг/день (системное воздействие было в 10 раз сильнее, чем у человека при приеме терапевтической дозы 10 мг/день). Исследования на крысах в дозе 0,5, 1,5 или 5 мг/кг/день не выявили увеличения частоты опухолевых заболеваний, связанного с приемом препарата. Воздействие препарата на крыс в высшей дозировке в четыре раза превышало воздействие терапевтической дозировки препарата на человека. Адефовира дипивоксил обладал мутагенным действием на клетки лимфомы мыши при исследовании in vitro (с метаболической активацией и без нее). Адефовир индуцировал хромосомные аберрации в исследовании in vitro лимфоцитов периферической крови человека без метаболической активации. Адефовир не показал кластогенных свойств при микроядерном исследовании in vivo на мышах в дозах до 2000 мг/кг. Тест Эймса на обратную мутацию бактерий с использованием S. typhimurium и E. Coli с метаболической активацией и без нее не выявил мутагенных свойств адефовира. Исследования токсического действия адефовира на репродуктивную функцию не выявили признаков нарушения детородной функции у самок и самцов крыс, получавших препарат в дозах до 30 мг/кг/день (системное воздействие в 19 раз выше, чем воздействие препарата на человека при приеме терапевтических доз).
Беременность
Препарат относится к категории С:
Исследования репродуктивной функции при назначении адефовира дипивоксила внутрь не выявили эмбриотоксического и тератогенного действия у крыс в дозах до 35 мг/кг/день (системное воздействие приблизительно в 23 раза выше, чем воздействие препарата на человека при приеме терапевтической дозы 10 мг/день), и у кроликов в дозе 20 мг/кг/день (системное воздействие в 40 раз выше, чем у человека).
При внутривенном введении адефовира беременным крысам в дозах, связанных со значительным токсическим действием на организм матери (20 мг/кг/день, системное воздействие в 38 раз сильнее, чем у человека), наблюдалось эмбриотоксическое действие и увеличение частоты пороков развития плода (анасарка, недоразвитие глазного яблока, пупочная грыжа и перекрученный хвост). При внутривенном введении адефовира беременным крысам в дозе 2,5 мг/кг/день (системное воздействие в 12 раз сильнее, чем у человека) не отмечалось никакого неблагоприятного действия на развитие плода.
Адекватных и хорошо контролируемых исследований действия препарата на беременных женщин не проводилось. Поскольку исследования репродуктивной функции животных не всегда позволяют предсказать результат воздействия препарата на человека, во время беременности использовать HEPSERA следует только в случае крайней необходимости, после тщательного обсуждения возможного риска и пользы от его применения.
Регистр исходов беременности
Для наблюдения за исходами беременности у женщин, принимавших HEPSERA во время беременности, был создан регистр исходов беременности. Сотрудников учреждений здравоохранения просят регистрировать пациенток, позвонив по телефону 1-800-258-4263.
Роды
Исследований с участием беременных женщин не проводилось, отсутствуют данные о влиянии HEPSERA на передачу вируса гепатита В от матери к ребенку. Поэтому необходимо осуществлять соответствующую иммунизацию ребенка, для предотвращения заражения вирусом гепатита В в неонатальном периоде.
Кормление грудью
Неизвестно, проникает ли адефовир в женское молоко. Необходимо инструктировать матерей о прекращении грудного вскармливания, если они принимают HEPSERA.
Применение у детей
Безопасность и эффективность применения HEPSERA у детей не изучена.
Применение у пожилых пациентов
В клинических исследованиях HEPSERA не участвовало достаточное количество лиц старше 65 лет, поэтому нельзя установить, отличается ли ответ пожилых пациентов на препарат от ответа более молодых пациентов. В целом, следует соблюдать осторожность при назначении HEPSERA лицам старшего возраста, поскольку у них чаще бывают нарушены функции почек или сердца вследствие сопутствующих заболеваний или приема других лекарств.
ПОБОЧНЫЕ ЯВЛЕНИЯ
Оценка побочных реакций основана на результатах двух исследований (437 и 438), в которых приняло участие 522 пациента с хроническим гепатитом В. Пациенты получали двойное слепое лечение HEPSERA (n = 294) или плацебо (n = 228) в течение 48 недель. При продолжении лечения в течение второго 48-недельного периода 492 пациента получали лечение вплоть до 109 недели, со средней продолжительностью лечения, равной 49 неделям.
За исключением специфических побочных явлений, описанных в разделе МЕРЫ ПРЕДОСТОРОЖНОСТИ, все связанные с лечением клинические побочные явления, которые были зафиксированы у 3% и более пациентов, получавших HEPSERA (по сравнению с плацебо), представлены в Таблице 6.
Таблица 7 суммирует отклонения в лабораторных показателях 3 и 4 степени, обнаруженные на фоне лечения HEPSERA по сравнению с плацебо.
Таблица 6.Побочные явления, связанные с лечением (степень 1 - 4), зафиксированные более чем у 3% всех пациентов, получавших HEPSERA в ходе исследований 437 - 438 (0 - 48 недель)
* ВГН - верхняя граница нормы
Среди пациентов с адекватной функцией почек к 48 неделе увеличение уровня креатинина сыворотки крови = 0,3 мг/дл от исходного уровня было зафиксировано у 4% пациентов, получавших HEPSERA в дозе 10 мг/сут, и у 2% пациентов, получавших плацебо. Ни у одного из пациентов к 48 неделе уровень креатинина в сыворотке крови не увеличился >/= 0,5 мг/дл от исходного уровня. К 96 неделе у 10% и у 2% пациентов, получавших HEPSERA, повышение уровня креатинина составило соответственно >/= 0,3 мг/дл и >/= 0,5 мг/дл от исходного уровня (после 48 недели плацебо-контролируемое исследование не проводилось) (оценка методом Каплана-Мейера). Из 492 пациентов у 29 уровень сывороточного креатинина повысился >/= 0,3 мг/дл от исходного уровня, причем у 20 из этих 29 пациентов уровень креатинина снизился на фоне продолжающегося лечения ( /= 0,3 мг/дл от исходного уровня на 48 неделе было зафиксировано у 26% пациентов, на 96 неделе - у 37% пациентов (оценка по Каплану-Мейеру). Повышение сывороточного креатинина >/= 0,5 мг/дл от исходного уровня на 48 неделе было зафиксировано у 16% пациентов, на 96 неделе - у 31% пациентов. У 41 из 324 пациентов уровень сывороточного креатинина повысился >/= 0,5 мг/дл от исходного уровня, причем у 7 из 41 пациента уровень креатинина снизился на фоне продолжающегося лечения ( /= 50
Пациенты на гемодиализе
Рекомендуемая доза и интервал между приемами
10 мг каждые 24 часа
10 мг каждые 48 часов
10 мг каждые 72 часа
По 10 мг 1 раз в неделю после гемодиализа
*Клиренс креатинина, рассчитанный по формуле Кокрофта-Голта исходя из тощей или идеальной массы тела.
Оценка фармакокинетики адефовира не проводилась у пациентов с клиренсом креатинина менее 10 мл/мин, не получающих гемодиализ, по этой причине отсутствуют рекомендации о дозировке препарата у таких пациентов.
ФОРМА ВЫПУСКА
HEPSERA выпускается в виде таблеток белого цвета. В каждой таблетке содержится 10 мг адефовира дипивоксила. На одной стороне таблетки есть гравировка "10" и "GILEAD", а на другой стороне - стилизованный рисунок печени. Расфасовка: банки по 30 таблеток (NDC 61958-0501-1) с крышкой, защищенной от открывания детьми. Внутри банки находится поглотитель влаги (силикагель).
Хранить в оригинальной упаковке при температуре 25°С, разрешаются колебания температуры от 15 до 30°С.
Не используйте лекарство, если пленка, закрывающая горлышко банки, порвана или отсутствует.
Gilead Sciences, Inc.
Foster City, CA 94404
HEPSERA® является зарегистрированной торговой маркой Gilead Sciences, Inc.
© 2002, 2003 Gilead Sciences, Inc.
GILEAD
Трувада предназначен для лечения ВИЧ1 инфекции у взрослых в комбинации с другими антиретровирусными препаратами (такими как ненуклеозидные ингибиторы обратной транскриптазы или ингибиторы протеазы).
Указания для детей и беременныхТрувада не рекомендуется детям до 18 лет, беременным и в период лактации.
Контролируемые исследования у беременных женщин непроводились. Труваду используют во время беременности по жизненным показаниям,если отсутствует альтернативное лечение.
ВИЧ-инфицированным матерям не рекомендуют кормить грудью сцелью предупреждения риска постнатальной передачи ВИЧ. Неизвестно, проникает литенофовира дизопроксила фумарат или эмтрицитабин в грудное молоко. Из-за рискапередачи ВИЧ-инфекции и возможности возникновения тяжелых побочных реакций уноворожденного не рекомендуется грудное вскармливание на протяжении терапиипрепаратом.
В состав препарата входит лактозы моногидрат, который нерекомендуется пациентам с наследственной непереносимостью лактозы, дефицитом ферментаLAPP-лактазы, мальабсорбцией глюкозы-галактозы.
Применение Трувада должно сопровождаться эффективнойконтрацепцией.
Особенности влияния лекарственного средства на способностьуправлять транспортным средством или потенциально опасными механизмами
Учитывая побочные действия лекарственного средства следует соблюдать осторожность при управленииавтотранспортом и другими потенциально опасными механизмами
Трувада - это комбинированный препарат с фиксированной дозой эмтрицитабина и тенофовира дизонроксила фумарата.
Препарат Трувада обладает специфичной активностью по отношению к вирусу иммунодефицита человека (ВИЧ-1 и ВИЧ-2) и вирусу гепатита В.
1 таблетка, покрытая пленочной оболочкой, содержит:
действующие вещества :эмтрицитабина 200 мг, тенофовира 300 мг;
в упаковке 30 таблеток.
Необходимо с осторожностью подбирать дозу для пожилых пациентов, учитывая большую частоту нарушений функции печени, почек или сердца, а также сопутствующие заболевания или прием других лекарственных препаратов.
ВзаимодействиеСовместное применение тенофовира дизопроксила фумарата идиданозина в дозе 400 мг в сутки приводит к усилению системного действиядиданозина. Следует проводить тщательное наблюдение за пациентами, которыеодновременно применяют тенофовира дизопроксила фумарата и диданозин,относительно побочных эффектов, связанных с диданозином (панкреатит,лактоцидоз). Супрессия количества лимфоцитов CD4 наблюдалась у пациентов,которые получали тенофовира дизопроксила фумарат с диданозином в дозе 400 мг всутки. Взрослым пациентам с массой тела более 60 кг дозу диданозина следуетуменьшить до 250 мг в сутки. Информация относительно рекомендаций по коррекциидозы диданозина для пациентов с массой тела менее 60 кг отсутствует.
Следует состорожностью назначать ТРУВАДА совместно с диданозином.
Атазанавир и лопинавир/ритонавир проявляли способностьповышать концентрацию тенофовира. Необходимо тщательно контролировать состояниепациентов, которые получают атазанавир и лопинавир/ ритонавир вместе с Трувада.Пациентам, у которых развились побочные эффекты, связанные с Трувада, следуетпрекратить применение препарата.
Тенофовир уменьшает AUC (площадь под фармакокинетическойкривой) и Сmin (минимальную концентрацию в плазме крови) атазанавира. Присовместном назначении с Трувада рекомендуется принимать атазанавир 300 мгвместе с ритонавиром 100 мг. Не следует принимать одновременно атазанавир иТрувада без ритонавира.
Эмтрицитабин и тенофовир выводятся, в основном, почками.Одновременное применение Трувада с препаратами, которые ослабляют функцию почекили конкурируют за активную канальцевую секрецию, может повысить концентрации всыворотке крови эмтрицитабина, тенофовира и/или других препаратов, которыевыводятся почками. Примерами могут служить ацикловир, адефовира дипивоксила,цидофовир, ганцикловир, валацикловир и валганцикловир.
Вероятность возникновения CYP450 взаимодействийэмтрицитабина и тенофовира с другими лекарственными средствами невелика.
Не отмечалось клинически значимых лекарственныхвзаимодействий между эмтрицитабином и фамцикловиром, индинавиром, ставудином,тенофовира дизопроксила фумаратом, зидовудином. Не наблюдалось клиническизначимых лекарственных взаимодействий между тенофовира дизопроксилафумаратом иабакавиром, адефовира дипивоксилом, ифавиренцом, эмтрицитабином, индинавиром,ламивудином, лопинавиром/ритонавиром, метадоном, нельфинавиром, пероральнымиконтрацептивами, рибавирином, саквинавиром/ритонавиром.
Симптомы :усиление побочных эффектов.
Лечение :следует придерживаться стандартной поддерживающейтерапии. Гемодиализом выводится до 30 % дозы эмтрицитабина и 10 % дозытенофовира.
Лечение должен начинать врач, имеющий опыт в лечении ВИЧ-инфекции. Рекомендуемая доза Трувада - 1 таблетка, которая принимается перорально1 раз в сутки, для оптимизации всасывания рекомендуется принимать с пищей.
Пациенты пожилого возраста: следует с осторожностью подбирать дозу для пожилых пациентов, учитывая большую частоту нарушенийфункции печени, почек или сердца, а также сопутствующие заболевания или приемдругих лекарственных средств.
Индивидуальная непереносимость компонентов Трувада.
ПротивопоказанияНе рекомендуется применение препарата Трувада как составного элемента трехкомпонентнойнуклеозидной схемы лечения.
Труваду не следует вводить одновременно с Атриплой,Эмтривой или Виреадом. Из-за схожестиэмтрицитабина и ламивудина Труваду не следует вводить одновременно с другимипрепаратами, содержащими ламивудин, включая Комбивир (ламивудин/зидовудин),Эпивир или Эпивир-HBV (ламивудин), Эпзиком (абакавира сульфат/ ламивудин/зидовудин). Труваду нельзя вводить с Хепсерой (аденовира дипивоксил).
Клинические исследования у пациентов инфицированных ВИЧ показали,что определенные схемы, содержащие только три нуклеозидных ингибитора обратнойтранскриптазы (НИОТ), обычно менее эффективны, чем тройные схемы препаратов,содержащие два НИОТ в комбинации с ненуклеозидным ингибитором обратнойтранскриптазы либо ингибитором ВИЧ-1 протеазы. В частности, сообщалось о раннейвирусологической неэффективности и высокой частоте замещения резистентности.Поэтому схемы тройных нуклеозидов следует применять с осторожностью. Пациенты,получающие лечение с применением схем с тремя нуклеозидами должны находитьсяпод тщательным контролем врача и необходимо рассмотреть вопрос об изменениилечения.
Лактат-ацидоз/выраженное увеличение печени со стеатозом.
При применении аналогов нуклеозидов в виде монотерапии илисовместно с другими антиретровирусными препаратами были сообщения олактат-ацидозе и выраженное увеличение печени со стеатозом, включая летальныеслучаи. Большинство таких случаев наблюдалось у женщин. Ожирение и применениенуклеозидов длительного действия могут являться факторами риска. С особойосторожностью следует применять аналоги нуклеозидов у пациентов с известнымифакторами риска при заболевании печени, однако такие случаи былизарегистрированы у пациентов и без наличия известных факторов риска. Припоявлении у пациента клинических или лабораторных признаков лактат-ацидоза илиявной гепатотоксичности (которые могут включать увеличение печени и стеатоздаже при отсутствии выраженного повышения уровня трансаминаз), лечениепрепаратом следует прекратить.
Пациенты, одновременно инфицированные ВИЧ и вирусом гепатитаВ.
Всем ВИЧ-инфицированным пациентам перед началомантиретровирусной терапии рекомендуется провести анализ на наличие хроническогогепатита В. Трувада не одобрена для лечения хронической инфекции вирусагепатита В (HBV). Хотя безопасность и эффективность Трувады не установлены идля пациентов, одновременно инфицированных вирусом гепатита В и ВИЧ, сообщалосьо выраженном резком обострении гепатита В у пациентов, одновременноинфицированных ВИЧ и HBV, которые прекратили применять эмтрицитабин илитенофовира дизопроксила фумарат.
У некоторых пациентов, которые получалилечение эмтрицитабином, обострение гепатита В сопровождалось печеночнойдекомпенсацией и повреждением печени. У пациентов, одновременно инфицированныхВИЧ и HBV, которые прекратили применение Трувада, функцию печени следует контролироватьклиническими и лабораторными методами, по крайней мере, на протяжениинескольких месяцев. При необходимости следует начать лечение гепатита В.
Нарушения со стороны почек.
Эмтрицитабин и тенофовира дизопроксила фумарат выводятся, восновном, почками. Отмечены нарушения со стороны почек, включая случаи остройпочечной недостаточности и синдром Фанкони (поражение почечных канальцев стяжелой гипофосфатемией), которые ассоциируются с применением тенофовирадизопроксила фумарата. Всем пациентам рекомендуется определять клиренскреатинина перед началом лечения, а также по клинической необходимости во времятерапии препаратом. У пациентов с угрозой почечной недостаточности необходимопостоянно контролировать уровни клиренса креатинина и фосфора в сывороткекрови.
Всем пациентам с клиренсом креатинина 30-49 мл/минрекомендуется коррекция интервала между дозами Трувада и тщательное наблюдениеза функцией печек. Трувада не следует назначать пациентам, которым необходимгемодиализ. Следует избегать назначения препарата одновременно или после недавнегоприменения нефротоксических действующих веществ.
Влияние на костную систему.
Наблюдалось уменьшение относительно начального уровняминеральной плотности костной ткани в костях поясничного отдела и бедренныхкостях во время лечения Трувада. Большинство случаев снижения минеральнойплотности костной ткани наблюдалось на протяжении первых 24-48 недель исохранялось в течение 144 недель исследования. У ВИЧ-инфицированных пациентов спатологическими переломами костей в анамнезе или имеющих повышенный риск остеопении,следует наблюдать за состоянием костной ткани.
Липодистрофия
У пациентов, получавших антиретровирусную терапию, наблюдалиперераспределение жиров организма (липодистрофия), включая отложение жира вобласти живота, дорсоцервикальное отложение жира ("горб бизона"),потерю жировой ткани на конечностях, лице, увеличение груди и"кушингоидный вид". Механизм и отдаленные последствия этих явлениинеизвестны. Высокий риск липодистрофии связан с индивидуальными факторами,такими как пожилой возраст, длительное лечение антиретровирусными препаратами исвязанные с ними метаболические нарушения.
Синдром иммунного восстановления.
В начальной фазе комбинированного антиретровирусного леченияу пациентов, иммунная система которых реагирует на лечение, возможно развитиевоспалительной реакции на замедленные или остаточные оппортунистическиеинфекции (инфекции, вызванные Mycobacterium avium, цитомегаловирусная инфекция,пневмония, вызванная Pneumocystis jirovecii (РСР), или туберкулез), что можетпотребовать дальнейшего обследования и лечения.
Так как Трувада содержит эмтрицитабин и тенофовира дизопроксил фумарат, то при его приеме возможно возникновение побочных реакций, по характеру и степени тяжести сходных с теми, которые возникают при приеме этих антиретровирусных препаратов.
Со стороны системы крови и кроветворных органов: нейтропения, анемия.
Со стороны иммунной системы: аллергические реакции, в том числе ангионевротический отек.
Со стороны обмена веществ: гипофосфатемия, гипергликемия, лактат-ацидоз, гипергриглицеридемия, гипокалиемия.
Со стороны нервной системы: головокружение, головная боль, бессонница, депрессия. Со стороны дыхательной системы: одышка.
Со стороны желудочно-кишечного тракта: диарея, рвота, тошнота, метеоризм, повышение активности амилазы, боль в животе, вздутие, панкреатит, диспепсия, повышение активности липазы.
Со стороны печени и желчевыводящих путей: гипербилирубинемия, гепатит, жировая дистрофия печени, повышение активности печеночных трансаминаз (чаще всего аспартатаминотранферазы, аланинаминотрансферазы, гамма-глутамилтранспептидазы).
Со стороны кожи и подкожно-жировой клетчатки: кожная сыпь, иногда сопровождающаяся зудом (макуло-папулезная сыпь, крапивница, везикулярно-булезная, пустулезная сыпь), изменение цвета кожи (в основном на ладонях и/или подошвах стоп).
Со стороны опорно-двигательного аппарата: повышение уровня креатинкиназы, рабдомиолиз, остеомаляция (проявляется болью в костях, изредка приводит к переломам), мышечная слабость, миопатия.
Со стороны мочевыделительной системы: нарушения функции почек, в том числе острые, почечная недостаточность, острый некроз канальцев почек, синдром Фанкони, почечная тубулопатия проксимального типа, интсрегициальный нефрит, нефрогенный несахарный диабет, повышение концентрации креатинина, протеинурия, полиурия.
Прочие: астения, утомляемость.
Возможны аллергические реакции ,анемия ,гипергликемия, головная боль, тошнота, почечная недостаточность.