









 Рейтинг: 4.6/5.0 (1845 проголосовавших)
Рейтинг: 4.6/5.0 (1845 проголосовавших)Категория: Инструкции
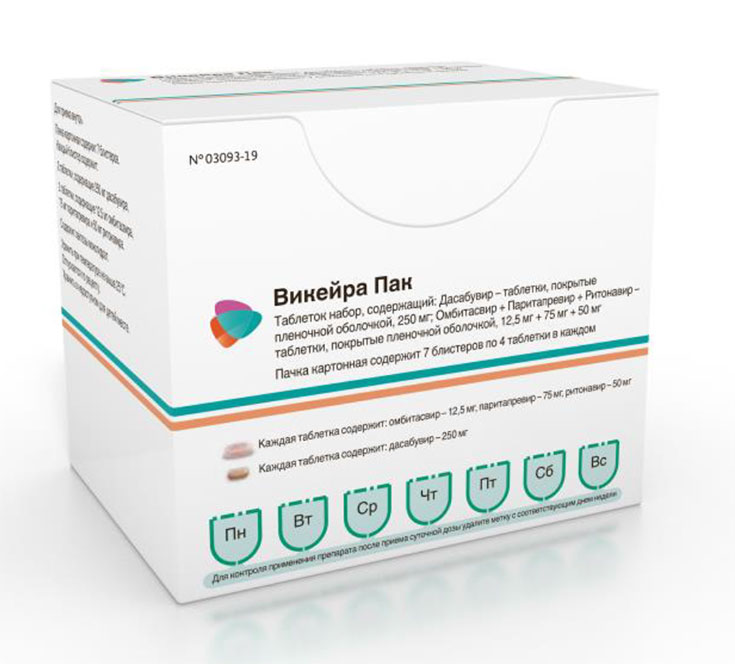
Латинское название: Viekira Pak™ Состав и форма выпуска:
Состав пленочной оболочки: Опадрай II розовый - 32.5 мг, в т. ч. поливиниловый спирт - 46.94%, макрогол 3350 - 23.7%, тальк - 17.36%, титана диоксид - 11.9%, железа оксид красный - 0.1%.
Состав пленочной оболочки: Опадрай II бежевый - 21 мг, в т. ч. поливиниловый спирт - 40%, титана диоксид - 21.55%, макрогол 3350 - 20.2%, тальк - 14.8%, железа оксид желтый - 3%, железа оксид красный - 0.35%, железа оксид черный - 0.1%.
По 4 шт. (2 таб. + 2 таб.) в блистерах, в пачках картонных.
Описание лекарственной формы:
Таблетки, покрытые пленочной оболочкой розового цвета, продолговатые, двояковыпуклые, с гравировкой AV1 на одной стороне.
Таблетки, покрытые пленочной оболочкой светло-коричневого цвета, овальные, с гравировкой AV2 на одной стороне.
Показания: Хронический гепатит С генотипа 1, включая пациентов с компенсированным циррозом печени, в сочетании с рибавирином или без него. Противопоказания:С осторожностью: cовместное применение препарата Викейра Пак и флутиказона. или других глюкокортикостероидов, которые метаболизируются с участием изофермепта CYP3A4. Совместное применение с антиаритмическими препаратами. Печеночная недостаточность средней степени тяжести.
Применение при беременности и кормлении грудью:Результаты качественных и хорошо контролируемых исследований в отношении применения препарата Викейра Пак у беременных женщин отсутствуют.
В исследованиях на животных с применением омбитасвира/паритапревира/ритонавира и его основных неактивных метаболитов у человека (М29, М36), а также дасабувира, какого-либо влияния на развитие эмбриона и плода отмечено не было. В испытаниях с применением паритапревира/ритонавира использовались максимальные дозы, соответствующие 98- кратной (у мышей) или 8-кратной (у крыс) рекомендуемой клинической дозе у людей. В испытаниях с применением омбитасвира использовались максимальные дозы, соответствующие 28-кратной (у мышей) или 4-кратной (у кроликов) рекомендуемой клинической дозе у людей. Самые высокие дозы основных неактивных метаболитов человека в исследовании на мышах давали - экспозиции в 26 раз выше, чем в организме человека при использовании рекомендуемых клинических доз. В испытаниях с применением дасабувира использовались максимальные дозы, соответствующие 48- кратной (у крыс) или 12-кратной (у кроликов) рекомендуемой клинической дозе у людей.
В связи с тем, что невозможно сделать выводы по применению препарата у беременных женщин, основываясь на данных, полученных на животных, препарат Викейра Пак следует применять во время беременности только в случае крайней необходимости, обоснованной клинической ситуацией.
Совместное применение с рибавирином
Рибавирин может вызывать пороки развития и/или смерть плода. Пациентам-женщинам и партнершам пациентов-мужчин следует принимать максимально возможные меры, чтобы избежать беременности, поскольку в исследованиях на животных у всех видов, подвергшихся воздействию рибавирина, было подтверждено выраженное тератогенное действие и/или эмбриоцидный эффект. Не следует применять схему лечения с использованием рибавирина до тех пор, пока непосредственно перед началом терапии не будет получен отрицательный результат теста на беременность. На период лечения и в течение не менее 6 мес после его окончания женщинам детородного возраста и их партнерам, а также пациентам мужского пола и их партнершам рекомендуется использовать не менее двух эффективных способов контрацепции. В течение всего времени лечения с применением рибавирина ежемесячно должны проводиться плановые тесты на беременность.
Период грудного вскармливания
Нет информации о проникновении омбитасвира, паритапревира, ритонавира или дасабувира и их метаболитов в грудное молоко у женщин.
Паритапревир и продукт его гидролиза M13, омбитасвир и дасабувир в неизмененном виде были преобладающими компонентами, обнаруженными в молоке кормящих крыс без влияния на кормящихся детенышей. Из-за возможности возникновения побочных реакций вследствие воздействия препарата на грудных детей, должно бьпь принято решение о прекращении грудного вскармливания или прерывании лечения препаратом Викейра Пак с учетом важности терапии для матери. Пациентам, получающим рибавирин, необходимо ознакомиться с его инструкцией по применению.
Способ применения и дозы:
Препарат Викейра Пак следует принимать во время еды, независимо от жирности или калорийности пищи.
Рекомендуемая доза препарата Викейра Пак включает 2 таб. омбитасвира/паритапревира/ритонавира 12.5/75/50 мг 1 раз/сут (утром) и 1 таб. дасабувира 250 мг 2 раза/сут (утром и вечером). У некоторых групп пациентов препарат Викейра Пак используется в комбинации с рибавирином (см. Таблицу 1).
В Таблице 1 приведены рекомендуемые схемы лечения и продолжительность терапии в зависимости от группы пациентов.
Таблица 1. Схема лечения и ее продолжительность для разных групп пациенток (впервые начинающих лечение или после терапии интерфероном.
Примечания:
* Рекомендуется следовать режиму дозирования для генотипа Iа у больных с неизвестным подтипом генотипа I или генотипом I смешанного типа.
** Схема применения препарата Викейра Пак в комбинации с рибавирином в течение 12 недель может быть рассмотрена для некоторых пациентов на основе предшествующей терапии.
При применении с препаратом Викейра Пак, рекомендуемая доза рибавирина основывается на массе тела пациента: 1000 мг/сут для пациентов с массой тела 75 кг, разделенная на 2 приема в день с едой. При необходимости коррекции дозы рибавирина рекомендуется ознакомиться с его инструкцией по применению. Препарат Викейра Пак следует принимать в соответствии с продолжительностью, рекомендованной и инструкции по его применению, без перерыва. Если препарат Викейра Пак применяется совместно с рибавирином, то рибавирин следует назначать на тот же срок, что и препарат Викейра Пак.
Пациенты после трансплантации печени
Рекомендуемая продолжительность лечения пациентов с нормальной функцией печени и стадией фиброза по шкале Metavir-2 и менее после трансплантации печени с применением препарата Викейра Пак в комбинации с рибавирином составляет 24 недели, независимо от генотипа ВГС 1 подтипа. При применении препарата Викейра Пак с ингибиторами кальциневрина необходима коррекция дозы ингибиторов кальциневрина. В клинических исследованиях у пациентов после трансплантации печени были индивидуально подобраны дозы рибавирина, которые составляли от 600 мг до 800 мг в день.
У пациентов с ко-инфекцией ВГС/ВИЧ-1
Следует выполнять рекомендации, указанные в Таблице 1. Рекомендации по сопутствующей противовирусной терапии ВИЧ-1 представлены в разделе Взаимодействие с другими лекарственными препаратами.
У пациентов с легкой степенью печеночной недостаточности (класс А по Чайлд-Пью) коррекции дозы препарата Викейра Пак не требуется. Безопасность и эффективность препарата Викейра Пак у пациентов, инфицированных гепатитом С, со средней печеночной недостаточностью (класс В по Чайлд-Пью) не была установлена; применение препарата Викейра Пак не рекомендуется у пациентов со средней степенью печеночной недостаточности. Препарат Викейра Пак противопоказан у пациентов с тяжелой формой печеночной недостаточности (класс С по Чайлд-Пыо).
До начала терапии и в течение курса следует проводить контроль показателей функции печени.
Опыт клинических исследований
Если препарат Викейра Пак применяется с рибавирином: для получения информации о побочных реакциях рибавирина, необходимо ознакомиться с его инструкцией по применению.
Оценка безопасности основана на объединенных данных фазы 2 и 3 клинических испытаний более чем у 2600 пациентов, получавших препарат Викейра Пак с рибавирином или без него.
Препарат Викейра Пак в сочетании с рибавирином (в т.ч. у пациентов с циррозом)
У пациентов, получающих препарат Викейра Пак в сочетании с рибавирином, наиболее частыми наблюдавшимися побочными реакциями (более чем у 20% пациентов) были усталость и тишнота. Количество пациентов, полностью прекративших .лечение из-за побочных реакций, составило 1.2% (25/2044), 1.3% (27/2044) пациентов прервали (с возможностью дальнейшего возобновления) лечение из-за побочных эффектов. 7.7% (158/2044) пациентам потребовалось снижение дозы рибавирина вследствие возникновения побочных реакции.
Профиль безопасности препарата Викейра Пак и рибавирина у пациентов с циррозом был таким же, что и у пациентов без цирроза.
Применение препарата Викейра Пак без рибавирина
У пациентов в клиническом исследовании, получавших препарат Викейра Пак без рибавирина, единственной зафиксированной побочной реакцией был зуд. Количество пациентов, полностью прекративших лечение из-за побочных реакций, составило 0.3% (2/588). 0.5% (3/588) пациентов сделали перерывы в лечении из-за побочных реакции.
В Таблице 2 перечислены нежелательные явления, связанные или не связанные с применением препарата Викейра Пак, зафиксированные в двух рандомизированных планебо-контролируемых испытаниях (SAPPHIRE I и SAPPHIRE II), которые наблюдались с частотой, как минимум на 5% выше, чем у пациентов, получающих препарат Викейра Пак в комбинации с рибавирином, по сравнению с пациентами, получавших плацебо. Кроме того, Таблица 2 включает в себя список этих побочных реакций в трех исследованиях, в которых пациенты получали препарат Викейра Пак с рибавирином или без него (PEARL II, PEARL III и PEARL IV), и анализ этих побочных реакций в исследованиях у пациентов с циррозом печени, получавших препарат Викейра Пак в комбинации с рибавирином в течение 12 или 24 недель (TURQUOISE II).
Таблица 2. Сводная таблица частот нежелательных явлений, выявленных в Фазе 3 клинических исследовании 1 ' 2 .
Исследования SAPPHIRE I и II
Исследования PEARL II, III и IV
1 - перечисленные побочные реакции возникали с частотой более 5% среди пациентов, получавших Викейра Пак в комбинации с рибавирином по сравнению с пациентами, получавшими плацебо в SAPPHIRE I и II.
2 - расположение граф таблицы предусмотрено для упрощения презентации; прямые сравнения не должны проводиться для результатов исследований, отличающихся по дизайну.
3 - группировочный термин зуд включает предпочтительный термин зуд и генерализованный зуд.
4 - группировочный термин включает: сыпь, эритема, экземы, макуло-папулезная сыпь, дерматит в т.ч. аллергический и контактный, папулезная сыпь, эксфолиативные явления, сыпь, сопровождающаяся зудом, эритематозная сыпь, генерализованная сыпь, реакции фоточувствительности, псориаз, кожные реакции, изъязвления, крапивница.
Большинство побочных реакций в фазе 3 клинических испытаний были легкой степени тяжести (1 класс). Профиль безопасности препарата Викейра Пак при совместном применении с рибавирином согласуется с имеющимся профилем безопасности рибавирина.
В исследованиях PEARL-II, -III и -IV, у 7% пациентов, получавших препарат Викейра Пак в виде монотерапии и у 10% пациентов, получавших препарат Викейра Пак в сочетании с рибавирином, отмечались проявления дерматита в виде сыпи. В исследованиях SAPPHIRE-I и II у 16% пациентов, получавших препарат Викейра Пак с рибавирином и у 9% пациентов, получавших плацебо, отмечались нежелательные явления со стороны кожи. В исследовании TURQUOISE II у 18% и 24% пациентов, получавших препарат Викейра Пак в сочетании с рибавирином в течение 12 либо 24 недель отмечались нежелательные явления со стороны кожи. Тяжесть большинства явлений классифицирована как легкая. Не зарегистрировано серьезных явлений и тяжелых кожных реакций, например, синдрома Стивенса-Джонсона, токсического эпидермального некролиза, мультиформной эритемы, аллергического дерматита, связанного с приёмом лекарственных средств (с эозинофилией и системными симптомами).
Отклонения от нормы лабораторных показателей
Изменения отдельных лабораторных показателей приведены в Таблице 3.
Таблица 3. Выборочные отклонения лабораторных показателен, возникшие во время лечения 2 .
Исследования SAPPHIRE I и II
1 - верхняя граница нормы в соответствии с лабораторными данными.
2 - расположение граф таблицы предусмотрено для упрощения презентации; прямые сравнения не должны проводиться для результатов исследоваий отличающихся по дизайну.
Повышение активности AЛT в сыворотке крови
В ходе клинических исследований с применением препарата Викейра Пак с рибавирином и без него, у менее 1% пациентов, которые не применяли эстрогенсодержащие препараты, было обнаружено временное повышение активности АЛТ более чем в 5 раз от верхней границы нормы после начала лечения.
У женщин на фоне сопутствующего применения препаратов, содержащих этинилэстрадиол, частота случаев повышения активности АЛТ увеличилась до 25% (4/16). Частота случаев клинически значимого увеличения активности АЛТ среди женщин, получавших другие эстрогены, кроме этинилэстрадиола (например, эстрадиол и конъюгированные эстрогены) в качестве гормоно-заместительной терапии, составляла 3% (2/59).
Как правило, это явление было бессимптомным, проявлялось в течение первых 4 недель лечения и разрешалось по мере продолжения терапии. Повышение активности АЛТ, как правило, не связано с повышением концентрации билирубина. Цирроз не был фактором риска для повышения активности АЛТ. Для большинства пациентов не требуется особого мониторинга биохимических показателей печени.
Повышение концентрации билирубина
Временное повышение концентрации билирубина (преимущественно непрямого) наблюдалось у пациентов, получающих препарат Викейра Пак в сочетании с рибавирином, что связано с ингибированием паритапревиром транспортеров билирубина ОАТР1В1/1ВЗ и вследствие гемолиза, вызванного применением рибавирина. Повышение концентрации билирубина происходило после начала лечения, достигало пика на неделе I исследования, и полностью разрешалось по мере продолжения терапии. Повышение концентрации билирубина не было связано с повышением концентрации аминотрансфераз. Частота повышения непрямого билирубина была ниже среди пациентов, которые не получали рибавирин.
Применение препарата Викейра Пак у пациентов с ко-инфекцией ВГС/ВИЧ-1
Применение препарата Викейра Пак в сочетании с рибавирином оценивалось у 63 пациентов с ко-инфекцией ВГС/ВИЧ-1, которые получали антиретровирусную терапию на стабильной основе. Наиболее распространенные нежелательные явления, зарегистрированные как минимум у 10% пациентов: слабость (48%), бессонница (19%), тошнота (17%). головная боль (16%), зуд (13%). кашель (11%), раздражительность (10%), иктеричность склер (10%).
Повышение концентрации общего билирубина в 2 и более раз относительно верхней границы нормы (чаще - за счет непрямого билирубина) зарегистрировано у 34 пациентов (54%). 15 из них в период повышения концентрации билирубина принимали атазанавир, у 9 пациентов также отмечались иктеричность склер, желтуха или гипербилирубинемия. У пациентов с гипербилирубинемией не отмечалось сопутствующего увеличения активности аминотрансфераз. Случаев увеличения активности АЛТ 3 степени не зарегистрировано.
У 7 пациентов (11%) было зарегистрировано как минимум по одному случаю снижения концентрации гемоглобина ниже 10 г/дл; у 6 из них проведена коррекция дозы рибавирина. В данных случаях переливания крови и назначения эритропоэтина не потребовалось.
В конце 12 и 24 недель терапии отмечалось уменьшение среднего количества CD4 + Т-клеток до концентрации 47 клеток/мм 3 и 62 клеток/мм 3 соответственно; в большинстве случаев после завершения курса терапии показатели вернулись к исходным. У 2 пациентов в ходе курса терапии зарегистрировано снижение количества CD4 + Т-клеток до концентрации менее 200 клеток/мм 3 без снижения CD4 +. Случаев СПИД-ассоциированных оппортунистических инфекций зарегистрировано не было.
Применение препарата Викейра Пак у реципиентов трансплантата печени
Применение препарата Викейра Пак в сочетании с рибавирином оценивалось у 34 пациентов, перенесших трансплантацию печени, с рецидивом ВГС. Нежелательные явления, зарегистрированные более чем у 20% пациентов: слабость (50%). головная боль (44%), кашель (32%), диарея (26%), бессонница (26%), астения (24%), тошнота (24%), мышечные спазмы (21%), сыпь (21%). У 10 пациентов (29%) отмечалось как минимум по одному случаю снижения концентрации гемоглобина до концентрации менее 10 г/дл. У 10 пациентов проводилась коррекция дозы рибавирина по причине снижения концентрации гемоглобина; у 3% (1/34) пациентов курс терапии рибавирином прерывался. 5 пациентов получали эритропоэтин; у всех этих пациентов начальная доза рибавирина составляла 1000-1200 мг в сутки. Переливания крови не проводились.
Самые высокие документально зафиксированные разовые дозы, назначаемые здоровым добровольцам, составляли 400 мг для паритапревира (+100 мг ритонавира), 200 мг для ритонавира (+100 мг паритапревира), 350 мг для омбитасвира и 2000 мг для дасабувира. В случае передозировки рекомендуется проводить мониторинг появления любых признаков или симптомов побочных реакций и, в случае необходимости, немедленного проведения соответствующей симптоматической терапии.
В исследованиях in vitro отмечено, что ритонавир ингибирует некоторые изоферменты цитохрома Р450, однако препарат Викейра Пак в клинически значимых концентрациях не оказывает существенного влияния на изоферменты CYP2C9 и CYP2C19.
Паритапревир, ритонавир и дасабувир, являются ингибиторами Р-гпикопротеина in vilro, однако значительных изменений при взаимодействии препарата Викейра Пак с дигоксином - чувствительным субстратом Р-гликопротеина - не отмечено.
Паритапревир является ингибитором транспортного полипептида органических анионов 1B1 и 1В3 (ОАТР1В1 и ОАТР1В3). Паритапревир, ритонавир и дасабувир являются ингибиторами белка резистентности рака молочной железы (Breast Cancer Resistance Protein, BCRP).
Паритапревир, омбитасвир и дасабувир являются ингибиторами изоформы 1А1 (UGT1A1) уридиндифосфатглюкуронилтрансферазы, а ритонавир является ингибитором изофермента цитохрома CYP3A4. Совместное применение препарата Викейра Пак с препаратами, которые в первую очередь метаболизируются посредством изофермента CYP3A или являются субстратами для UGT1A1, BCRP, OATP1B1 или OATP1B3, может привести к увеличению плазменной концентрации таких препаратов.
Паритапревир, омбитасвир, ритонавир и дасабувир in vivo не ингибируют транспортер органических анионов (ОАТ1), также маловероятно то, что они ингибируют транспортеры органических катионов (ОСТ1 и ОСТ2), транспортеры органических анионов (ОАТ3) или белки множественной резистентности и выведения токсинов Влияние других лекарственных препаратов на препарат Викейра Пак Совместное использование препарата Викейра Пак с мощными ингибиторами изофермента CYP3A может увеличить, концентрацию паритапревира до 2 раз. Совместный прием препарата Викейра Пак с препаратами, которые индуцируют изофермент CYP3A, ведет к ожидаемому снижению концентрации дасабувира, паритапревира, омбитасвира и ритонавира в плазме крови и снижают их терапевтический эффект. Совместное применение препарата Викейра Пак с препаратами, которые ингибируют изофермепт CYP2C8, может увеличить концентрацию дасабувира в плазме крови. Совместный прием препарата Викейра Пак с препаратами, которые индуцируют изофермент CYP2C8, ожидаемо ведет к снижению концентрации дасабувира в плазме крови и уменьшает его терапевтический эффект. Изменение экспозиции (Сmах и AUC) паритапревира, омбитасвира и дасабувира от 0.5 до 2.0 раз не считается клинически значимым и не требует коррекции дозы препарата Викейра Пак. Препарат Викейра Пак может назначаться совместно с препаратами, которые являются ингибиторами изофермента CYP3A, в то же время противопоказано сочетать прием препарата Викейра Пак с мощными ингибиторами изофермента CYP2C8 или индукторами изофермента CYP3A/2C8. Паритапревир, дасабувир и ритонавир являются субстратами Р-гликопротеина. Паритапревир и дасабувир являются субстратами BCRP. Омбитасвир является субстратом Р-гликопротеина и/пли BCRP. Паритапревир является субстратом OATP1B1 и OATP1B3. Однако, маловероятно, что иигибирование Р-гликопротеипа. BCRP, OATP1B1 или ОАТР1B3 приведет к клинически значимому увеличению экспозиции препарата Викейра Пак. Установленные и другие потенциально возможные лекарственные взаимодействия Профиль взаимодействия лекарственных средств, используемых совместно с препаратом Викейра Пак, разработан для ряда наиболее часто назначаемых препаратов для совместного применения (Таблица 4). Если пациент в настоящее время уже принимает лекарственный препарат(-ы), который вероятно обладают потенциалом для лекарственного взаимодействия, или начал принимать их во время терапии препаратом Викейра Пак, рекомендуется рассмотреть необходимость коррекции дозы сопутствующего препарата(-ов) или проведение необходимого клинического мониторинга. Если на время лечения препаратом Викейра Пак производилась коррекция доэ совместно применяемых препаратов, по окончании терапии препаратом Викейра Пак следует провести их коррекцию. В Таблице 4 приведена информация по влиянию совместного применения препарата Викейра Пак на концентрации совместно применяемых препаратов. При назначении совместно применяемых препаратов, перечисленных в таблице 4, коррекция дозы препарата Викейра Пак не требуется. Таблица 4. Установленное лекарственное взаимодействие на основе данных исследовании по лекарственным взаимодействиям препаратов. Класс сопутствующего лекарственного средства/название препарата Влияние на концентрацию Рекомендуется клиническое наблюдение за больными. Допускается уменьшение дозы альпразолама в зависимости от клинического ответа. Направление стрелки указывает напревление изменения экспозиции (Cmax и AUC) (^ увеличение более чем на 20%, v - снижение более чем на 20%, - - нет изменения или изменения менее чем 20%). Перечень препаратов, совместное применение которых с препаратом Викейра Пак противопоказано, представлен в разделе Противопоказания. Препараты, с которыми лекарственное взаимодействие при совместном применении с препаратом Викейра Пак не наблюдалось В исследованиях, касающихся взаимодействия лекарственных препаратов, не обнаружено никакого клинически значимого взаимодействия между препаратом Викейра Пак следующими наиболее часто совместно назначаемыми препаратами: При совместном применении этих препаратов с препаратом Викейра Пак корректировки дозы не требуются. В ходе клинических исследований препарата Викейра Пак с рибавирином или без рибавирина, приблизительно в 1% случаев, наблюдалось преходящее, бессимптомное повышение активности АЛТ более чем в 5 раз выше верхней границы нормы происходило (см. раздел Побочное действие). Увеличение активности АЛТ значительно чаще отмечалось у женщин, принимавших препараты на основе этипилэстрадиола, например, комбинированные пероральные контрацептивы, контрацептивные пластыри и контрацептивные вагинальные кольца (см. раздел Противопоказания). Повышение активности АЛТ обычно наблюдалось в течение 4 недель терапии и уменьшалось в течение 2-8 недель с момента начала повышения активности АЛТ при продолжении терапии препаратом Викейра Пак с рибавирипом или без рибавирина. Следует прекратить прием препаратов, содержащих этинилэстрадиол до начала применения препарата Викейра Пак. Во время курса терапии препаратом Викейра Пак рекомендуется использовать альтернативные методы контрацепции (например, пероральпые контрацептивы на основе прогестина, либо негормональные контрацептивы). Возобновление приема препаратов, содержащих этинилэстрадиол рекомендуется начинать спустя примерно 2 недели после окончания курса терапии препаратом Викейра Пак. У женщин, получавших не этинилэстрадиол, а другие эстрогены (например, эстрадиол и конъюгированиые эстрогены) в качестве заместительной гормонотерапии, показатели активности АЛТ соответствовали показателям, зарегистрированным у пациенток, не получавших эстрогены. Тем не менее, поскольку число пациенток, получавших другие эстрогены, ограничено, применять их в сочетании с препаратом Викейра Пак следует с осторожностью. Биохимические показатели печени следует измерять в течение первых 4 недель терапии и если показатели активности АЛТ в сыворотке превышают верхнюю границу нормы, то необходимо повторно провести исследование и далее контролировать активность АЛТ таких пациентов, а также: Риски, связанные с одновременным применением рибавирина В случае комбинированного применения препарат Викейра Пак с рибавирином следует учитывать предупреждения и предосторожности, применимые к рибавирину, в частости, нежелательность беременности. Полный перечень предупреждений и предосторожностей на фоне применения рибавирина представлен в инструкции по его применению. Риски, связанные с побочными эффектами или снижением эффекта от терапии вследствие одновременного назначения с другими препаратами Комбинированное применение ряда препаратов может привести к известным, либо потенциально значимым лекарственным взаимодействиям, в результате которых возможны: В Таблице 4 (раздел Взаимодействие с другими лекарственными препаратами) указаны меры по коррекции возможных и известных значимых лекарственных взаимодействий, в т.ч. - рекомендации по дозированию препаратов. Следует оценивать возможность развития лекарственных взаимодействий до начала применения препарата Викейра Пак и во время курса терапии; рекомендован мониторинг побочных реакций, связанных с приемом препаратов, применяемых совместно с активными и вспомогательными веществами препарата Викейра Пак. Использование совместно с флутиказоном Флутиказон - глюкокортикостероид, метаболизирующийся посредством изофермента CYP3A. Следует соблюдать осторожность при совместном применении препарата Викейра Пак и флутиказона или других глюкокортикостероидов, которые метаболизируются с участием изофермента CYP3A4. Совместное применение ингаляционных глюкокортикостероидов, метаболизирующихся посредством изофермепта CYP3A, может увеличить системное воздействие глюкокортикостероидов; были зарегистрированы случаи возникновения синдрома Кушинга и последующего подавления функции надпочечников препаратами, содержащими ритонавир. Совместное применение препарата Викейра Пак и глюкокортикостероидов, в частности для длительной терапии, следует начинать, только в случае, если потенциальная польза лечения перевешивает риск системных эффектов глюкокортикостероидов. У пациентов с легкой степенью печеночной недостаточности (класс А по Чаплд-Пью) коррекция дозы препарата Викейра Пак не требуется. Безопасность и эффективность препарата Викейра Пак у пациентов, инфицированных гепатитом С, со средней степенью печеночной недостаточностью (класс В по Чайлд-Пью) не была установлена; не рекомендуется применять препарат Викейра Пак со средней степенью печеночной недостаточности. Препарат Викейра Пак противопоказан у пациентов с тяжелой формой печеночной недостаточности (класс С по Чайлд-Пыо). Препарат Викейра Пак не рекомендуется для применения у пациентов с декомпенсированными заболеваниями печени. Риск развития резистентности к ингибиторам протеазы ВИЧ-1 у пациентов с ко-инфекцией ВГС/ВИЧ-1 Ритонавир, который входит в состав препарата Викейра Пак, относится к ингибиторам протеазы ВИЧ-1 и может способствовать селекции аминокислотных замен, ассоциированных с резистентностью к ингибиторам протеазы ВИЧ-1. У пациентов с ко-инфекцией ВГС/ВИЧ-1, которые получают курс терапии препаратом Викейра Пак, следует также проводить антиретровирусную терапию, направленную на уменьшение риска развития резистентности к ингибиторам протеазы ВИЧ-1. Пациенты nocле трансплантации печени Безопасность и эффективность применения препарата Викейра Пак в комбинации с рибавирином изучалась у 34 пациентов с ВГС генотипа 1 после трансплантации печени (как минимум 12 мес после трансплантации печени). Основными целями данного исследования было оценить безопасность и определить долю пациентов, достигших устойчивого вирусологического ответа через 12 недель после окончания лечения (SVR12) и после 24 недель лечения препаратом Викейра Пак в комбинации с рибавирином. Начальная доза рибавирина составляла от 600 мг до 800 мг в день, как наиболее часто применяющаяся в начале и в конце лечения препаратом Викейра Пак. Тридцать четыре участника, не получавшие лечения по поводу ВГС после трансплантации печени и имевшие оценку фиброза по шкале Metavir-2 или меньше (29 с генотипом ВГС 1а и 5 с генотипом ВГС 1b) были включены в клинические исследования. Тридцать один из 32 пациентов, для которых были получены данные во временной точке SVR12 (96.9%) достигли SVR12 (96.3% у пациентов с генотипом 1а). Один пациент с генотипом ВГС 1a имел рецидив после лечения. Общий профиль безопасности препарата Викейра Пак в комбинации с рибавирином у ВГС-инфицированных пациентов после трансплантации печени был таким же, что и у пациентов, получавших препарат Викейра Пак в комбинации с рибавирином в фазе 3 клинических исследований, за исключением возникновения анемии. Десять пациентов (29.4%) имели хотя бы одно значение гемоглобина (после исходного) менее 10 г/дл. У 55.9% (19/34) пациентов доза рибавирина была снижена и у 2.9% (1/34) применение рибавирина было отменено. Изменение дозы рибавирина не повлияло па частоту достижения устойчивого вирусологического ответа. У пяти пациентов потребовалось применение эритропоэтина (у всех пяти пациентов ежедневно применялся рибавирин в начальной дозе от 1000 мг до 1200 мг. Ни одному пациенту не потребовалось переливание крови). Другие генотипы ВГС В отношении пациентов, инфицированных другими генотипами ВГС, за исключением генотипа 1, безопасность, и эффективности, препарата Викейра Пак не была установлена. Влияние комбинированного применения омбитасвира/паритапревира/ритонавира и дасабувира на интервал QTc оценивали в рандомизированном двойном слепом исследовании с плацебо и активным контролем (моксифлоксацин 400 мг), 4-полосным перекрестом, тщательным мониторингом QT у 60 здоровых субъектов. получавших омбитасвир/паритапревир/ритонавир и дасабувир. В исследовании с возможностью обнаруживать малые эффекты в дозах, превышающих терапевтические - паритапревир 350 мг, ритонавир 150 мг, омбитасвир 50 мг и дасабувир 500 мг - не показали клинически значимой пролонгации интервала QT. Хранить в сухом месте при температуре не выше 25 °С. Хранить в недоступном для детей месте.
Данная информация предназначена для специалистов в области здравоохранения и фармацевтики. Пациенты не должны использовать эту информацию в качестве медицинских советов или рекомендаций.
AbbVie представила результаты исследования фазы 3b среди пациентов с хроническим гепатитом С генотипа 1b и компенсированным циррозом печениГлобальная биофармацевтическая компания AbbVie объявила результаты исследования TURQUOISE-III среди взрослых пациентов с хроническим вирусным гепатитом С (ХГС) генотипа 1b и компенсированным циррозом печени, которые продемонстрировали, что устойчивый вирусологический ответ был достигнут у 100% пациентов (n=60/60).
Пациенты получали терапию Викейра Пак (омбитасвир/паритапревир/ритонавир + дасабувир в таблетках) без рибавирина на протяжении 12 недель. Эти новые результаты исследования фазы 3b компании AbbVie были представлены на 15-ом Ежегодном международном симпозиуме по вопросам изучения вирусных гепатитов и заболеваний печени в Берлине, Германия.
Около 160 миллионов человек по всему миру заражены ХГС. Генотип 1 вируса гепатита С является наиболее распространенным, составляя около 60% случаев в мире в целом и в Европе в частности. при этом наиболее распространенным является подтип 1b (47%). С течением времени хронический гепатит С может привести к тяжёлым последствиям для печени, включая компенсированный цирроз печени, который развивается у 10-20% больных.
«Генотип 1b вируса гепатита С является самым распространённым в мире среди больных ХГС, и необходимо продолжать изучение перспективных схем терапии этого заболевания, – сказал доктор Джордан Фелд (Jordan J. Feld), директор по клиническим исследованиям Центра по заболеваниям печени, Торонто, Канада. – Результаты исследования TURQUOISE-III являются многообещающими и демонстрируют, что пациенты с хроническим гепатитом С генотипа 1b и компенсированным циррозом печени могут достичь высоких показателей вирусологического ответа на схеме терапии без интерферона и рибавирина на протяжении 12 недель».
В исследование TURQUOISE-III были включены пациенты, как ранее получавшие (с неудачей лечения пегилированным интерфероном и рибавирином), так и не получавшие противовирусную терапию. Никто из пациентов, участвовавших в исследовании, не прервал лечение из-за нежелательных явлений. Наиболее частыми нежелательными явлениями (>10 %) были утомляемость (22%), диарея (20%) и головная боль (18%).
«Участвовавшие в исследовании TURQUOISE-III пациенты с хроническим гепатитом С генотипа 1b и компенсированным циррозом печени достигли 100%-ного показателя излечения на терапии препаратом Викейра Пак без рибавирина, – заявил доктор Скотт Брюн (Scott Brun), вице-президент по развитию портфеля препаратов компании AbbVie. – TURQUOISE-III является частью нашей программы исследований фазы 3b, которая направлена на расширение знаний об использовании разработанного AbbVie режима терапии среди различных групп пациентов с ХГС в клинической практике и поддерживает дальнейшие исследования в этой области».
Описание исследования TURQUOISE-III
TURQUOISE-III – многоцентровое, открытое исследование фазы 3b, изучавшее эффективность и безопасность 12-недельного режима терапии Викейра Пак без рибавирина у взрослых пациентов (n=60) с хроническим вирусным гепатитом С генотипа 1b и компенсированным циррозом печени, ранее не получавших противовирусное лечение или с безуспешным опытом лечения (при использовании пегилированного интерферона и рибавирина). Основным оцениваемым показателем было достижение устойчивого вирусологического ответа через 12 недель после окончания лечения (SVR12) .
Ни один пациент не испытал вирусологическую неудачу во время лечения и ни у одного из пациентов не было рецидива по окончанию терапии.
О терапии препаратом Викейра Пак
Препарат Викейра Пак одобрен в США, России и других странах (в Европе одобрены 2 препарата—Exviera (дасабувир) и Viekirax (омбитасвир /паритапревир/ ритонавир)) для лечения хронического вирусного гепатита С 1-го генотипа, включая пациентов с компенсированным циррозом печени.
Викейра Пак включает фиксированную комбинацию 150 мг паритапревира (ингибитор протеазы NS3/4A), 100 мг ритонавира и 25 мг омбитасвира (ингибитор NS5A), применяемых один раз в сутки (две таблетки), а также 250 мг дасабувира (ненуклеозидный ингибитор полимеразы NS5B), который применяется два раза в сутки. Викейра Пак принимается в комбинации с рибавирином или без него два раза в сутки в зависимости от группы пациентов. Викейра Пак принимается на протяжении 12 недель с или без рибавирина, за исключением части пациентов с ХГС генотипа 1a, компенсированным циррозом печени и нулевым ответом на двойную терапию пегилированным интерфероном и рибавирином в анамнезе, а также пациентов, перенесших трансплантацию печени, которым требуется терапия в течение 24 недель.
Паритапревир был обнаружен в ходе продолжающегося сотрудничества между компаниями AbbVie и Enanta Pharmaceuticals в области исследований ингибиторов протеаз вируса гепатита С и схем терапии, которые включают ингибиторы протеазы. Паритапревир был разработан AbbVie для использования в сочетании с другими исследуемыми компанией препаратами для лечения гепатита С.
Дополнительная информация об исследуемой программе в области ХГС компании AbbVie доступна на сайте www.clinicaltrials.gov.
Программа компании AbbVie по разработке терапии вирусного гепатита С
Клиническая программа AbbVie по гепатиту С, направленная на расширение научного знания и клинической помощи, исследует безинтерфероновый полностью пероральный режим в комбинации с рибавирином или без него с целью достижения высокой частоты устойчивого вирусологического ответа у как можно большего числа пациентов. Планируется, что глобальная программа исследований фазы 3b охватит свыше 2,800 пациентов с ХГС 1-го генотипа в более чем 200 исследовательских центрах по всему миру, включая США, Канаду, Европу, Россию и Бразилию.
Дополнительная информация об исследуемой программе в области ХГС компании AbbVie доступна на сайте www.clinicaltrials.gov.
Ниже представлены краткая инструкция по применению и информация о безопасности Викейра Пак. С полной инструкцией по применению и информацией о безопасности вы можете ознакомиться в дополнительном файле к данному материалу.
Показания к применению Викейра Пак в России
Хронический гепатит C генотипа 1, включая пациентов с компенсированным циррозом печени, в сочетании с рибавирином или без него. Нет необходимости в коррекции дозы препарата Викейра Пак в зависимости от возраста, пола, массы тела, расы и этнической принадлежности.
Противопоказания
Гиперчувствительность к омбитасвиру, паритапревиру, ритонавиру, дасабувиру или любым вспомогательным веществам препарата; тяжелая степень печеночной недостаточности (класс С по Чайлд-Пью); противопоказания к применению рибавирина (при совместном применении препарата Викейра Пак и рибавирина); одновременное применение с мощными ингибиторами CYP2C8, индукторами изофермента CYP3A, алфузозином; карбамазепином, фенитоином, фенобарбиталом, эфавирензом, алкалоидами спорыньи, гемфиброзилом, ловастатином, симвастатином, мидазоламом, триазоламом (внутрь), пимозидом, рифампицином, сальметеролом, препаратами зверобоя, силденафилом для лечения легочной артериальной гипертензии, рилпивирином, лопинавиром/ритонавиром, дарунавиром/ ритонавиром, препаратами этинилэстрадиола, атазанавиром/ритонавиром в фиксированной комбинации; детский возраст до 18 лет; дефицит лактазы, непереносимость галактозы, глюкозо-галактозная мальабсорбция.
С осторожностью
Совместное применение Викейра Пак и флутиказона или других глюкокортикостероидов, которые метаболизируются с участием изофермента CYP3A4; антиаритмическими препаратами. Печеночная недостаточность средней степени тяжести.
Способ применения и дозы
Викейра Пак следует принимать внутрь во время еды, независимо от жирности или калорийности пищи. Рекомендуемая доза препарата Викейра Пак включает две таблетки омбитасвира/паритапревира/ритонавира 12,5/75/50 мг один раз в день (утром) и одну таблетку дасабувира 250 мг два раза в день (утром и вечером).
Генотип 1а без цирроза Викейра Пак + рибавирин 12 недель
Генотип 1a с циррозом Викейра Пак + рибавирин 24 недели*
Генотип 1b без цирроза Викейра Пак 12 недель
Генотип 1b с циррозом Викейра Пак + рибавирин 12 недель
Рекомендуется следовать режиму дозирования для генотипа 1а у больных с неизвестным подтипом генотипа 1 или генотипом 1 смешанного типа.
* Схема применения препарата Викейра Пак в комбинации с рибавирином в течение 12 недель может быть рассмотрена для некоторых пациентов на основе предшествующей терапии.
У пациентов после трансплантации печени курс терапии Викейра Пак в комбинации с рибавирином составляет 24 недели при ХГС 1 генотипа при нормальной функции печени и стадии фиброза по шкале Metavir – 2 и менее. При применении препарата Викейра Пак с ингибиторами кальциневрина необходима коррекция дозы ингибиторов кальциневрина. Дозы рибавирина подбирались индивидуально и составляли от 600 мг до 800 мг в день.
У пациентов с ко-инфекцией ВГС/ВИЧ-1 следует выполнять стандартные рекомендации по режиму терапии. Рекомендации по сопутствующей противовирусной терапии ВИЧ-1 представлены в разделе «Взаимодействие с другими лекарственными препаратами».
Побочные действия
Оценка безопасности основана на объединенных данных фазы 2 и 3 клинических испытаний более чем у 2600 пациентов, получавших препарат Викейра Пак с рибавирином или без него. У пациентов, получавших препарат Викейра Пак в сочетании с рибавирином, наиболее частыми побочными реакциями (более чем у 20% пациентов) были усталость и тошнота.
Количество пациентов, полностью прекративших лечение из-за побочных реакций, составило 1,2% (25/2044). 1,3% (27/2044) пациентов прервали (с возможностью дальнейшего возобновления)
лечение из-за побочных эффектов. 7,7% (158/2044) пациентам потребовалось снижение дозы рибавирина вследствие возникновения побочных реакций. Профиль безопасности препарата Викейра Пак и рибавирина у пациентов с циррозом был таким же, что и у пациентов без цирроза. У пациентов в клиническом исследовании, получавших препарат Викейра Пак без рибавирина, единственной зафиксированной побочной реакцией был зуд. Количество пациентов, полностью прекративших лечение из-за побочных реакций, составило 0,3% (2/588). 0,5% (3/588) пациентов сделали перерывы в лечении из-за побочных реакций. Для получения подробной информации о побочных эффектах, пожалуйста, обратитесь к полной инструкции по медицинскому применению.
Лекарственные взаимодействия
Информацию о лекарственных взаимодействиях можно найти в полной инструкции по применению. Список препаратов, противопоказанных к применению с препаратом Викейра Пак указан в разделе «противопоказания».
Особые указания
В ходе клинических исследований препарата Викейра Пак с рибавирином или без рибавирина, приблизительно в 1% случаев наблюдалось преходящее, бессимптомное повышение активности АЛТ более чем в 5 раз выше верхней границы нормы. Биохимические показатели печени следует измерять в течение первых 4-х недель терапии. Если показатели активности АЛТ в сыворотке превышают верхнюю границу нормы, необходимо повторно провести исследование и далее контролировать активность АЛТ у таких пациентов. У пациентов с ко-инфекцией ВГС/ВИЧ-1, которые получают курс терапии препаратом Викейра Пак, следует также проводить антиретровирусную терапию, направленную на уменьшение риска развития резистентности к ингибиторам протеазы ВИЧ-1.
Инструкция по медицинскому применению препарата различается в разных странах; для получения полной информации ознакомьтесь с инструкцией препарата, разработанной для России.