








 Рейтинг: 4.2/5.0 (1851 проголосовавших)
Рейтинг: 4.2/5.0 (1851 проголосовавших)Категория: Инструкции
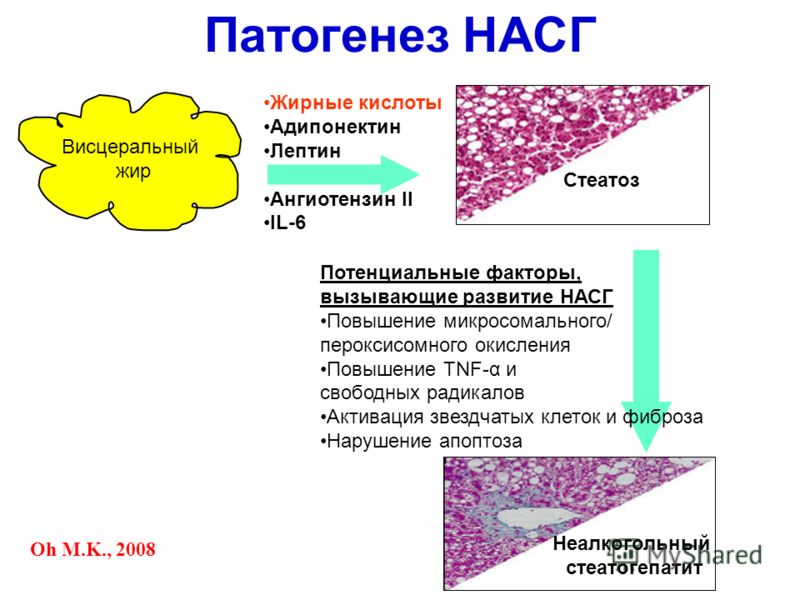
Адипонектин (другие названия ACRP30, GBP28) имеет массу 30 kDa, его секреция адипоцитами стимулируется инсулином. Адипонектин находится в достаточном количестве в крови - около 0,01% общего белка плазмы. Циркулирующий адипонектин существует в нескольких олигомерных изоформах, включая тримеры, гексамеры и мультимеры более высокого порядка. Биологическая роль олигомеризации еще не выяснена, но показано, что она принципиальна для проявления биологической активности.
При каких симптомах делается Адипонектин? Для проверки/улучшения работоспособности каких органов нужно делать Адипонектина?Печень, почки, нервная система, эндокринная система.
Повышения нормы наблюдаются при следующих заболеваниях АдипонектинаЧем выше содержание гормона, секретируемого жировыми клетками, тем меньше риск развития инфаркта миокарда. Полагают, что гормон противодействует накоплению жиров в стенках артерий, таким образом уменьшая вероятность образования тромбов, которые могут приводить к инфаркту миокарда. Также существуют данные о том, что адипонектин способствует уменьшению воспалительной реакции, которая вносит свой отрицательный вклад в развитие сердечной патологии.
Понижения нормы наблюдаются при следующих заболеваниях АдипонектинаСнижение экспрессии адипонектина коррелирует с инсулинорезистентностью, и что адипонектин связан с метаболизмом глюкозы. Введение рекомбинантного адипонектина угнетает синтез глюкозы в печени. Полагают, что адипонектин выполняет защитную функцию против гипергликемии, инсулинорезистентности и атеросклероза, по крайней мере, частично оказывая антагонистический эффект на активность TNF-α. TNF-α - воспалительный адипокин, повышенный уровень которого в плазме при ожирении связан с развитием гипергликемии и инсулинорезистентности. Более того, его способность супрессировть экспрессию гена адипонектина, возможно, основная причина снижения адипонектина при ожирении.
К каким докторам следует обращаться для консультаций по Адипонектину?Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Адипонектине или других анализах? Или же Вам необходим осмотр врача? Вы можете записаться на прием к доктору – клиника Eurolab всегда к Вашим услугам! Лучшие врачи осмотрят Вас, проконсультируют, окажут необходимую помощь и поставят диагноз. Вы также можете вызвать врача на дом. Клиника Eurolab открыта для Вас круглосуточно.
Как обратиться в клинику:
Телефон нашей клиники в Киеве: (+38 044) 206-20-00 (многоканальный). Секретарь клиники подберет Вам удобный день и час визита к врачу. Наши координаты и схема проезда указаны здесь. Посмотрите детальнее о всех услугах клиники на ее персональной странице.
Если Вами ранее были выполнены какие-либо исследования, обязательно возьмите их результаты на консультацию к врачу. Если исследования выполнены не были, мы сделаем все необходимое в нашей клинике или у наших коллег в других клиниках.
Необходимо очень тщательно подходить к состоянию Вашего здоровья в целом. Есть много болезней, которые по началу никак не проявляют себя в нашем организме, но в итоге оказывается, что, к сожалению, их уже лечить слишком поздно. Для этого просто необходимо по несколько раз в год проходить обследование у врача. чтобы не только предотвратить страшную болезнь, но и поддерживать здоровый дух в теле и организме в целом.
Если Вы хотите задать вопрос врачу – воспользуйтесь разделом онлайн консультации. возможно Вы найдете там ответы на свои вопросы и прочитаете советы по уходу за собой. Если Вас интересуют отзывы о клиниках и врачах – попробуйте найти нужную Вам информацию на форуме. Также зарегистрируйтесь на медицинском портале Eurolab. чтобы быть постоянно в курсе последних новостей и обновлений информации на сайте о Адипонектине и других анализах на сайте, которые будут автоматически высылаться Вам на почту.
Если Вас интересуют еще какие-нибудь анализы, диагностики и услуги клиник в целом или у Вас есть какие-либо другие вопросы и предложения – напишите нам. мы обязательно постараемся Вам помочь.
Новое открытие ученых Юго-западного медицинского центра (Southwestern Medical Center) Техасского университета (University of Texas) может разрешить 17-летнюю загадку о том, каким образом так называемый «гормон голодания» адипонектин оказывает влияние на многие биологические системы, включая чувствительность к инсулину и повышение выживаемости клеток.
Результаты последнего исследования обобщают многочисленные наблюдения о том, как функционирует гормон адипонектин, и в конечном итоге могут привести к новым методам лечения различных заболеваний – от диабета и потери веса до болезней сердца и рака.
«До сих пор не было выявлено отчетливой связи между всеми этими различными явлениями», - говорит доктор Филипп Шерер (Philipp Scherer), профессор кафедр внутренних болезней и клеточной биологии, старший автор статьи, опубликованной в журнале Nature Medicine.
Чтобы определить, как один и тот же гормон может оказывать настолько разностороннее воздействие, ученые использовали модели индуцированной запрограммированной смерти бета-клеток поджелудочной железы, вырабатывающих инсулин, и кардиомиоцитов, специфических клеток сердечной мышцы - миокарда.
«Эта статья показывает, что общим во всех этих различных видах активности является взаимодействие адипонектина со специфическим набором липидов, известных как церамиды», - говорит доктор Шерер, возглавляющий Touchstone Center for Diabetes Research.
Церимиды (керамиды) – семейство липидных молекул, известных своей способностью вызывать запрограммированную смерть клеток, или апоптоз. Высокие уровни церамидов, как было показано ранее, способствуют развитию диабета, нарушая индуцированные инсулином сигнальные клеточные пути и вызывая гибель бета-клеток поджелудочной железы.
Ученые установили, что введение адипонектина в клетки приводит к превращению церамидов из разрушающей силы в фактор, помогающий клеткам выживать, и подавляет апоптоз.
«Адипонектин, по существу, способствует преобразованию этого уродливого кузена», - объясняет доктор Шерер.
Доктор Вильям Холланд (William Holland), ведущий автор статьи, считает, что новые открытия имеют большое значение для лечения многих болезней, включая диабет и рак. «Красота этого исследования заключается в том, что его результаты подтверждаются как на животных моделях, так и in vitro. Используя модели апоптоза бета-клеток и кардиомиоцитов, нам удалось показать, что можно защитить эти клетки от запрограммированной смерти с помощью адипонектина» - говорит ученый.
Адипонектин, открытый доктором Шерером в 1994 году, не только контролирует чувствительность к инсулину, но и, как известно, играет важную роль в обмене веществ и ожирении. Предыдущие исследования показали, что при высоких уровнях адипонектина организм запасает избыточный жир в адипоцитах, или жировых клетках, чтобы защитить себя от возможного голодания в плохие времена. Эти запасы жира откладываются в основном в подкожной клетчатке, и экспрессия адипонектина в подкожном жире выше, чем в висцеральном. Адипонектин является специфическим адипокином, т.е. он синтезируется только адипоцитами. Экспрессия, секреция и плазменный уровень адипонектина снижаются при ожирении и абдоминальном распределении жировой ткани. Возникает своего рода парадокс: чем более выражено ожирение и чем больше адипоцитов, тем меньше вырабатываемого ими адипонектина.
При снижении уровня гормона организм начинает откладывать жир в опасных местах, таких как сердце, печень и мышечная ткань – где он может вызвать воспаление и привести к заболеваниям сердца. Поэтому ученые считают, что уровень адипонектина может быть хорошим предиктором риска развития диабета, болезней сердца и рака.
В целом, новые открытия «подтверждают гипотезу о том, что адипонектин является важным и, вероятно, ключевым регулятором уровня липидов», заключает доктор Шерер.
Н.А.Петунина 1. Н.Э.Альтшулер 2
1 ФППОВ ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава РФ;
2 Поликлиника №62, Москва
В 1994 г. был выделен первый адипоцитокинлептин. Многочисленные исследования открыли еще целый ряд гормонов жировой ткани, одними из которых являются адипонектин и резистин. Несмотря на их многочисленные функции, эти гормоны объединяет одно – их влияние в той или иной степени на сердечно-сосудистую систему. Исследования в этой области многочисленны, однако результаты противоречивы. Высокий уровень лептина является одним из прогностических факторов риска развития сердечнососудистых осложнений [1]. Резистин напрямую включается в атерогенез, являясь молекулярным соединительным звеном между воспалительным процессом и атеросклерозом кровеносных сосудов [2]. В то же время ряд исследований не выявили зависимости между содержанием резистина в плазме крови человека и чувствительностью к инсулину, индексу массы тела (ИМТ), артериальным давлением или липидным обменом [3]. Антисклеротическое действие адипонектина включает в себя стимуляцию пролиферации эндотелия, ингибирование пролиферации и миграции гладкомышечных клеток сосудов, подавление экспрессии в эндотелии молекул адгезии [4]. Вместе с тем ряд исследователей получили противоположные результаты [5].
В последние годы ряд авторов изучают роль адипонектина, резистина и лептина в регуляции основного обмена у пациентов на фоне сниженной функции щитовидной железы. Результаты исследований не дают однозначного ответа об участии адипоцитокинов в патогенетических процессах при гипотиреозе. Особенно этот вопрос был бы интересен в отношении субклинического гипотиреоза (СГ), так как пока нет окончательной точки зрения о механизмах развития метаболических нарушений при данной патологии. Также на сегодняшний день не существует единых показаний к проведению заместительной терапии СГ при тиреотропном гормоне – ТТГ 4,0–10,0 мЕд/л.
Целью настоящей работы было изучение влияния гормонов жировой ткани на механизмы развития инсулинорезистентности и показатели липидного обмена у пациентов с СГ в возрасте до 50 лет в зависимости от ИМТ, а также наличия или отсутствия заместительной терапии левотироксином (L-T4).
Материалы и методы
Работа выполнена на кафедре эндокринологии ФППОВ Первого МГМУ им. И.М.Сеченова (зав. кафедрой – д-р мед. наук, профессор Н.А.Петунина). Было проведено клиническое проспективное исследование «случай–контроль». Набор больных осуществлялся с 2008 по 2010 г. Под нашим наблюдением находились 44 пациента (женщины) с впервые выявленным СГ с уровнем ТТГ-медианы 5,6 мМЕ/л, не страдающие сердечно-сосудистыми заболеваниями. Полученные результаты были проанализированы по двум ключевым позициям: факту проведения заместительной терапии и ИМТ. Распределение пациентов проводилось методом случайной рандомизации на две равные подгруппы. В одной из подгрупп больным проводилась заместительная терапия L-T4 натрия, в другой заместительная терапия не назначалась. Исходная доза L-T4 натрия составляла до 1 мкг/кг, подбиралась индивидуально, под контролем ТТГ.
Известно также, что содержание гормонов жировой ткани зависит от степени выраженности ожирения. В связи с этим пациенты с СГ также были разделены по значению ИМТ в соответствии с классификацией Всемирной организации здравоохранения: нормальная масса тела – ИМТ 2 и избыточная масса тела – ИМТ в интервале 25–29,9 кг/м 2.
Помимо этого, была набрана контрольная группа без патологии щитовидной железы аналогичного возраста, пола и ИМТ в количестве 24 человек. Из контрольной группы исключались участники, имеющие повышенный уровень антител к тиреоидной пероксидазе (АТ-ТПО). У всех участников было получено информированное согласие на участие в исследовании. Критериями включения являлись возраст от 20 до 50 лет, СГ (ТТГ в диапазоне от 4,06 мМЕ/л до 10,0 мМЕ/л) при референсных значениях тироксина (Т4) и трийодтиронина (Т3). Критериями невключения явились возраст младше 20 и старше 50 лет; менопауза; сахарный диабет; злокачественные новообразования; болезни крови; хронический алкоголизм, наркотическая зависимость; хроническая почечная и печеночная недостаточность; острые воспалительные заболевания, хронические воспалительные заболевания в стадии обострения; беременность; психические расстройства; заболевания сердечно-сосудистой системы. Критерии исключения: отказ пациента от дальнейшего участия в исследовании; наступление беременности; обострение хронических сопутствующих заболеваний. Клинический мониторинг пациентов проводился в течение 6 мес. Перед началом исследования у всех пациентов и добровольцев собирали анамнез, производили клинический осмотр, включавший в себя измерение массы тела, роста, уровня артериального давления и частоты сердечных сокращений. Для анализа брали венозную кровь после 14-часового голодания, между 8.00 и 10.00 утра, в начале исследования и через 6 мес после первого визита. Определение содержания глюкозы (норма 3,9–4,9 ммоль/л) проводили ферментативным методом по конечной точке; иммунореактивный инсулин – ИРИ (норма 0,7–9,0 мкМЕ/мл) определялся (Insulin ELISA Monobind) методом иммуноферментного анализа. Степень инсулинорезистентности определялась «гомеостатической» моделью, HOMA-IR=гликемия натощак×ИРИ/22,5 (норма – менее 2,77). Для оценки концентрации общего холестерина – ОХС (норма 2–5,21 ммоль/л), триглицеридов – ТГ (норма 0,5–1,7 ммоль/л), холестерина (ХС) липопротеинов высокой плотности – ЛПВП (норма 0,91–1,56 ммоль/л) в сыворотке крови в работе использовался набор реагентов (BioSystems, Испания). Уровень ХС липопротеинов низкой плотности – ЛПНП (норма 0–4,0 ммоль/л) вычислялся по формуле: ХС ЛПНП=(ОХС - ХС ЛПВП - ТГ)/2,2; индекс атерогенности – ИА (норма 0–3,5 ммоль/л): (ОХ - ХС ЛПВП)/ХС ЛПВП. Набором ИРМА-ТТГ-СТ определялись концентрации ТТГ (норма 0,17–4,05 мМЕ/л), свободный Т3 (норма 2,5–5,8 пмоль/л), свободный Т4 (норма 11,5–23,0 пмоль/л), АТ-ТПО (не более 80 МЕ/мл) методом иммунорадиометричекого анализа на анализаторе «Наркотест НТ». Для определения уровня адипонектина (норма при ИМТ 2 8,2–19,1нг/мл; при ИМТ=25–30кг/м 2 5,3–22,5нг/мл, Biovendor Human Adiponectin ELISA); содержания лептина (норма для худощавых женщин 3,7–11,1 нг/мл, Diagnostics Biochem Canada Inc); в методике Biovendor Human Resistin ELISA, определялась концентрация резистина (норма 4,1–12,1 нг/мл). Гормоны жировой ткани определялись на анализаторе Model 680 Microplate Reader, иммуно-ферментным методом.
Статистический анализ проводился с использованием программы Biostatica (S.A.Glantz, издательский дом «Практика», 2006). Математический анализ полученных данных был выполнен непараметрическими статистическими критериями. Достоверность различий между двумя группами оценивалась критерием Манна–Уитни, изменение признака во времени оценивалось критерием Уилксона, внутригрупповые корреляции признаков оценивались при расчете коэффициента ранговой корреляции Спирмена. Данные в тексте и в таблицах представлены в виде медианы – Ме [25; 75], (25 и 75 – 1 и 3-й квартили). Критический уровень значимости при проверке нулевой гипотезы принимался меньше или равен 0,05.
Результаты и обсуждение
У пациентов с СГ по сравнению со здоровыми добровольцами были выявлены некоторые изменения, касающиеся показателей липидного профиля и чувствительности к инсулину (табл. 1). В частности, уровень ХС ЛПВП был достоверно ниже, а уровень ИРИ, значения HOMA-IR, ИА были выше в группе с СГ по сравнению со здоровыми добровольцами. Различия показателей в изучаемых группах носили достоверный характер. Что касается содержания гормонов жировой ткани, то показатели лептина, адипонектина и резистина находились в пределах референсных значений в обеих группах, однако уровень адипонектина был статистически значимо выше у пациентов с СГ. Как и следовало ожидать, была выявлена положительная корреляционная зависимость между содержанием адипонектина и антиатерогенной фракцией липидов–ХС ЛПВП (rs=0,44, р=0,003) при этом прослеживалась отрицательная корреляция с ТГ (rs=-0,36, р=0,017), глюкозой (rs=-0,32, р=0,036), инсулином (rs=-0,35, р=0,02), а также с такими расчетными параметрами, как HOMA-IR (rs=-0,37, р=0,013), ИМТ (rs=-0,46, р=0,002). Отрицательная взаимосвязь наблюдалась также с лептином (rs=-0,53, р=0,000).
Таблица 1. Сравнительная характеристика данных лабораторных исследований у пациентов с СГ и здоровых добровольцев.
Положительная корреляция лептина с ИМТ, подтвержденная многими исследованиями, наблюдалась и в нашей работе у пациентов с СГ (rs=0,52, р=0,000), HOMA-IR(rs=0,387, р=0,01); параллельно с этим выявлена отрицательная связь с ХС ЛПВП (rs=-0,440, р=0,003).
При анализе зависимости резистина от наблюдаемых параметров была отмечена положительная корреляция с ХС ЛПНП и ИА (rs=0,364, р=0,015; rs=0,41, р=0,007 соответственно).
Учитывая, что избыточная масса тела и ожирение вносят весомый вклад в изменение изучаемых параметров, соответственно пациенты на первом визите были разделены на группы и проанализированы в зависимости от массы тела.
При анализе данных, полученных при обследовании пациентов с СГ с нормальной массой тела и здоровых добровольцев с соответствующим ИМТ, на фоне повышенного уровня адипонектина наблюдались изменения в липидном обмене. В частности, уровень ХС ЛПВП был статистически значимо ниже 1,23 ммоль/л [1,2; 1,46] у пациентов с СГ (n=17) по сравнению с контрольной группой (n=12) – 1,5 ммоль/л [1,3; 1,8], (Т=236, р=0,014), а уровень адипонектина 15,2 мкг/мл [12,8; 16,4] был выше в исследуемой группе по сравнению с контрольной группой – 9,9 мкг/мл [9,9; 11,2], (Т=110; р=0,002).
В то же время при сравнении данных между пациентами с избыточной массой тела и добровольцами с аналогичной массой тела различия в уровне адипонектина не наблюдались, при этом были более выраженные изменения в липидном обмене, в том числе в снижении чувствительности к инсулину. Мы получили следующие результаты: уровень ХС ЛПВП 1,1 ммоль/л [0,85; 1,2] был ниже у пациентов с СГ по сравнению с контрольной группой 1,2 ммоль/л [1,1; 1,4]; (Т=308; р=0,04); концентрация ИРИ 10,0 мкМЕ/мл [9,3; 12,1], НОМА-IR 1,9 [1,7;2,2], коэффициент ИА 3,27 [2,4; 4,0] были выше в исследуемой группе, чем в контрольной: ИРИ 6,2 мкМЕ/мл [5,9; 6,5], (Т=135; р=0,001); НОМА-IR 1,2 [1,0; 1,5], (Т=145; р=0,004) и ИА 2,5 [2,1; 2,9], (Т=163; р=0,02) соответственно. Концентрации лептина, резистина в обеих подгруппах больных с СГ не отличались от соответствующих параметров в контрольной группе.
При анализе данных между подгруппами больных с СГ в зависимости от ИМТ более значимые изменения в липидном и углеводном обмене наблюдались в группе с избыточной массой тела (табл. 2).
Таблица 2. Характеристика обследованных пациентов с СГ в зависимости от ИМТ
СГ, ИМТ<24,9 кг/м 2
СГ, ИМТ>25 кг/м 2
Для более детального анализа полученных результатов пациенты, достигшие медикаментозного эутиреоза, были проанализированы по значению ИМТ, так как этот фактор вносит весомый вклад в изменения наблюдаемых нами параметров. В целом повышение уровня ХС ЛПВП наблюдалось как в подгруппе с ИМТ 2. так и в подгруппе с ИМТ>25 кг/м 2. При этом изменение в уровне адипонектина наблюдалось только в подгруппе с нормальной массой тела. Статистически значимое снижение уровня лептина отмечено в группе с ИМТ>25 кг/м 2. Наблюдаемая зависимость в очередной раз подтверждает, что СГ влияет на липидный обмен, а увеличение ИМТ ухудшает прогноз заболевания.
При оценке внутригрупповой корреляции у данных пациентов через 6 мес на фоне заместительной терапии было отмечена положительная корреляция лептина с ОХС (r=0,546,р=0,024), ТГ(rs=642,р=0,006) и резистином (rs=0,618,р=0,041). На фоне эутиреоза наблюдалась положительная корреляция между значением лептина и ТТГ (rs=0,618, р=0,009).
При обследовании через 6 мес 22 больных с СГ, не получивших заместительную терапию, мы получили следующие результаты: у одного пациента развился спонтанный эутиреоз; у 21 пациента сохранялся СГ, ТТГ-медиана = 5,5 [4,9; 5,5]; у большинства больных сохранялись субъективные жалобы (слабость, недомогание). По данным лабораторных исследований, через 6 мес мы не отметили значительных сдвигов в показателях липидного и углеводного обмена. Также в этой подгруппе пациентов не изменился уровень гормонов жировой ткани и ИМТ.
При оценке корреляции гормонов жировой ткани с исследуемыми показателями в данной подгруппе сохранялась положительная корреляция адипонектина с ХС ЛПВП (rs=0,479, р=0,029), а лептина – с ИМТ (rs=0,585, р=0,01).
Несмотря на полученную положительную динамику в показателях липидного профиля и улучшение чувствительности к инсулину на фоне терапии L-Т4, при сравнении результатов в подгруппах больных, получавших и не получавших заместительную терапию, через 6 мес по большинству параметров, исключая ТТГ, достоверных отличий получено не было. Статистически значимые различия между пациентами, достигшими медикаментозного эутиреоза, и пациентами, не получавшими заместительную терапию, наблюдались лишь по уровню ТТГ – 2,1 [1,6; 2,4]; 5,5 [4,9; 5,5] соответственно, (Т=231,0; р=0,000), адипонектина 9,4 [9,0; 11,2]; 14,1[9,1; 19,2] соответственно, (Т=406; р=0,038) и ИРИ 5,9 [4,7; 8,9]; 8,7 [7,5; 10,4] соответственно (Т=392; р=0,016). Оценка изменения уровня лептина в зависимости от наличия или отсутствия терапии не представлялась возможной, поскольку уровень лептина в подгруппе, которая не получала терапию, исходно была ниже – 25,5 [13,2; 46,1], чем в подгруппе, получавшей лечение, – 42,4 [19,4; 48,6] (Т=512; р=0,698); также дополнительная причина – небольшая выборка больных. Все полученные нами данные убедительно свидетельствуют в пользу проведения заместительной терапии у молодых женщин с СГ, что имеет целью не только компенсацию симптомов гипотиреоза при их наличии, но и профилактику поражения сердечно-сосудистой системы, путем влияния на факторы риска ее развития. Для проведения заместительной терапии в России зарегистрированы 9 дозировок Эутирокса, что позволяет оптимально подбирать дозу препарата, в том числе и при минимальной потребности.
ВыводыЛИТЕРАТУРА
1. Wolk R, Berger P, Lennon RJ et al. Plasma leptin and prognosis in patients with established coronary atherosclerosis. J Am Coll Cardiol 2004; 44: 1819–24.
2. Guzik TJ, Mangalat D, Korbut R. Adipocytokinesnovel link between inflammation and vascular function? J Physiol Pharmacol 2006; 57 (4): 505–28.
3. Farvid MS, Ng TW, Chan DC et al. Association of adiponectin and resistin with adipose tissue compartments, insulin resistance and dyslipidaemia. Diabetes Obes Metab 2005; 7 (4): 406–13.
4. Смирнов А.Н. Элементы эндокринной регуляции. М. ГЭОТАР-Медиа, 2008. с. 94–100.
5. Karastergiou К, Mohamed-Ali V, Jahangiri M at el. Adiponectin for prediction of cardiovascular risk? Br J Diabetes Vascular Dis. 2009; 9: 150.
Индекс лекарственных препаратов: Левотироксин натрия: ЭУТИРОКС (Такеда)
Дата документа: Март 2013 г.
Препарат АлвоСлим Генетика взял за свою основу мировой тренд в снижении веса — натуральный растительный компонент, являющийся экстрактом африканского манго IGOB131, который способен контролировать жировой обмен в Вашем теле и тем самым способствует наиболее эффективному снижению веса.
Довольно часто оказывается, что причиной избыточного веса оказывается наследственность, так как существует порядка 300 генов, оказывающих то или иное влияние на набор и снижение веса. И препараты для снижения веса АлвоСлим Генетика на основе африканского манго способны контролировать активность тех генов, которые участвуют в жировом обмене, тем самым оказывая влияние на жировой обмен и способствуя эффективному снижению веса.
Во время исследования действия экстракта африканского манго среднее изменение массы тела его участников составило 13 кг за 10 недель, что совпадает с физиологической нормой правильного снижения веса.
IGOB131в составе средства для снижения веса действует следующим образом:
Благодаря этому средство для снижения веса АлвоСлим Генетика регулирует жировой обмен, оставаясь полностью безопасным для здоровья человека. В отличие от многих других препаратов для похудения, АлвоСлим Генетика не имеет в своем составе психоактивных веществ, которые могут вызывать тахикардию, тошноту, рвоту и другие негативные последствия.
Форма выпуска и состав1 капсула содержит:
действующее вещество :экстракт африканского манго IGOB131;
в упаковке 60 шт.
30 декабря 2013
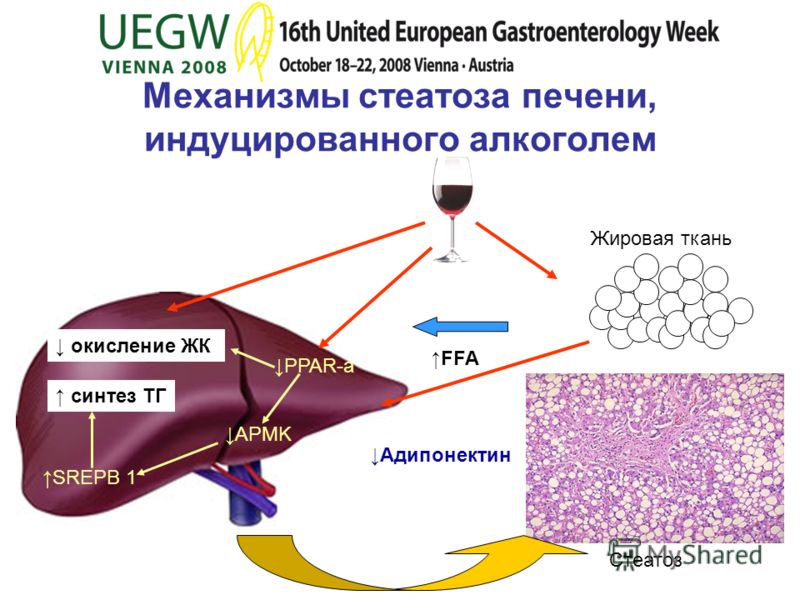
Рыбий жир - научные исследованияРыбий жир издавна известен своими полезными свойствами, особенно своим положительным действием на сердечнососудистую систему. В 2004 году управление по контролю качества пищевых продуктов и лекарственных средств (США) одобрило применение рыбьего жира для лечения гипертриглицеридемии (повышенного содержания в крови триглицеридов ). Однако, недавно в ходе нескольких исследований выяснилось, что рыбий жир обладает еще рядом полезных свойств, которые обязательно оценят по достоинству сторонники здорового образа жизни и бодибилдинга. Так вот, одним из выявленных свойств оказалась способность рыбьего жира уменьшать жировые отложения.

В 80-е и ранние 90-е годы несколько исследований с участием животных показали, что потребление рыбьего жира приводит к уменьшению жировых отложений в организме и тормозит увеличение массы тела. Причем, этот эффект наблюдался как при ограниченном потреблении калорий испытуемыми, так и при регулярном и даже чрезмерном. Отсюда можно сделать вывод, что жирные кислоты, содержащиеся в рыбьем жире, а именно ЭПК (эйкозапентаеновая кислота ) и ДГК (докозагексаеновая кислота ), влияют на реакцию окисления жира (его сжигание ) и способность организма запасать жировые ткани.
Механизм действияВ процессе изучения механизма воздействия рыбьего жира на жировые ткани организма ученые обнаружили, что рыбий жир благоприятно воздействует на обмен веществ, изменяя экспрессию гена (процесс, в ходе которого информация, зашифрованная в гене, преобразуется в белок ). Мы наследуем свои гены от родителей, но то, как эти коды ведут себя в жизни, во многом зависит от совокупности факторов окружающей среды. Питательные вещества, которые мы потребляем, - один из самых важных факторов. А одно из составляющих рациона, которое имеет большое влияние на наш набор генов — это жиры. Жирные кислоты пищевых жиров влияют не только на гормональную регуляцию, но и на молекулярные события, которые руководят экспрессией генов.  Было доказано, что жирные кислоты ЭПК и ДГК (влияя на экспрессию генов ) сдерживают активность ферментов синтезирующих жир (липогенных ), в то же время они стимулируют активность ключевых ферментов, отвечающих за расщепление жира.
Было доказано, что жирные кислоты ЭПК и ДГК (влияя на экспрессию генов ) сдерживают активность ферментов синтезирующих жир (липогенных ), в то же время они стимулируют активность ключевых ферментов, отвечающих за расщепление жира.
Рыбий жир повышает уровень адипонектина и уменьшает уровень кортизола в организме. Адипонектин — это новый вид белков, которые синтезируются в жировых тканях и циркулируют в плазме. Это один из физиологически активных полипептидов, чьи функции ученые начали изучать только в последние несколько лет. Он регулирует чувствительность к инсулину, снижает уровень сахара в крови и уровень триглицеридов, препятствует развитию атеросклероза и воспалительных процессов. Снижение экспрессии адипонектина связано с сопротивляемостью организма инсулину, кроме того, уровень адипонектина обратно пропорционален степени ожирения. Активность этого белка также связана с гормонами щитовидной железы, стероидными гормонами и глюкокортикоидами. Таким образом, влияние рыбьего жира на уровень адипонектина благотворно сказывается на нашем организме.
Свойства адипонектина еще до конца не изучены, но уже есть вероятность, что этот белок в будущем найдет применение в медицине.
Рыбий жир снижает уровень кортизола. До сих пор ученым досконально не известен механизм влияния кортизола на ожирение, но известно точно, что чрезмерный его уровень в организме приводит к увеличению массы тела. Таким образом, способность рыбьего жира снижать уровень кортизола может способствовать уменьшению жировых отложений. В другой статье я расскажу об этом свойстве рыбьего жира более детально.
Вы можете подумать: - «Все это замечательно, но я не крыса. Как рыбий жир действует на людей?»
Ученые провели исследование. В течение трех недель каждый день мужчины (участники исследования) получали вместо 6г жира оливкового, подсолнечного и арахисового масла 6 г рыбьего жира (соответствующих 1,1г ЭПК и 0,7г ДГК ). После 3 недель исследователи отметили эффект сжигания жира и снижение массы жировых тканей (измеренной с помощью ДЭРА) в среднем на 0,88 кг, при этом участники эксперимента регулярно получали необходимое им количество калорий. Поскольку их масса тела не изменилась, ученые сделали вывод, что рыбий жир способствует развитию сухой мышечной массы. Этот эффект можно было наблюдать, даже несмотря на то, что мужчины ничего не меняли в своем рационе питания и физических нагрузках.
Другое исследование подтвердило способность рыбьего жира повышать окисление жировых тканей (сжигание жира ) в процессе тренировки. В ходе эксперимента мужчины, которые активно занимались спортом, принимали каждый день в течение 3-х недель рыбий жир (доза соответствовала 2400 мг ЭПК и 1600 ДГК ). По окончанию эксперимента участники 60 минут бегали трусцой, при этом их уровень максимального потребления кислорода составлял 60%. По ходу пробежки у испытуемых измеряли жировой обмен. Результаты показали, что употребление рыбьего жира в процессе тренировок действительно способно значительно увеличить сжигание жира. Кроме того, у испытуемых наблюдалось значительное снижение уровня инсулина в крови, а после употребления продуктов, богатых углеводами, сжигание жира увеличилось на 35% .
Были опубликованы еще несколько исследований по этой теме. На этот раз предметами исследования стали тучные мужчины и женщины. В течение 12 недель ежедневно они получали 6 г рыбьего жира (соответствующих 360 мг ЭПК и 1560 мг ДГК ), а также выполняли физические упражнения (три раза в неделю занимались ходьбой по 45 минут, нагрузка составляла 75% возможной для их возраста ). В результате у участников улучшились показатели сердечнососудистой системы, и уменьшилась масса жировых отложений. Интересно, что эти эффекты были заметны, даже когда испытуемые продолжали придерживаться своих обычных предпочтений в еде. Это подтвердило, что потребление рыбьего жира вместе с физической активностью благотворно влияют на композицию тела и состояние сердечнососудистой системы. В этом исследовании, однако, у одной из групп (у которой не было физической нагрузки ) не наблюдалось снижения веса. Скорее всего, это было связано с возрастом исследуемых (47-51 год ) и относительно низкой дозой ЭПК. А еще у группы, которая сидела на диете, после 4-х недель употребления рыбьего жира наблюдалась потеря веса на 1 кг.
Некоторые деталиЕсть и такие исследования, в ходе которых не было выявлено никаких полезных результатов от употребления рыбьего жира. На это могли повлиять многие факторы (возраст, начальная масса тела, физическая подготовка ), а также разница в методике исследования и разница в содержании кислот (см. ниже). Однако несколько надежных исследований все же доказали, что рыбий жир в совокупности с другими средствами обладает способностью сжигать жир и улучшать некоторые жизненные показатели.
Потеря жировых отложений сопровождается увеличением сухой массы телаВ одном из последних экспериментов приняли участие мужчины и женщины в возрасте 33 года. Ежедневно они принимали 4 г рыбьего жира (1600 мг ЭПК и 800 мг ДГК ). Через 6 недель члены группы, которая получала плацебо в виде 4г подсолнечного масла, все как один набрали вес. Группа, которая потребляла рыбий жир, напротив, потеряла 0,5 кг жировых отложений и набрала 0,5 кг сухой мышечной массы, при этом масса тела испытуемых не изменилась. Это очень важный эффект для композиции тела. Кроме того, следует помнить, что простые измерения массы тела вам ничего не скажут об эффективности эксперимента, чтобы определить действие препарата измеряют отдельно массу жировой ткани и сухую мышечную массу.
НапоследокНа диете вы или нет, пищевая добавка в виде рыбьего жира поможет вам оставаться в форме. Дополнительные калории от добавки не принесут вам лишние килограммы, как раз наоборот, вы сможете избавиться от уже накопленных жировых отложений. И что самое замечательное, для этого вам не нужно будет менять свои кулинарные предпочтения и программу тренировок.
Ежедневно принимайте рыбий жир, который содержит, по крайней мере, 1600 мг ЭПК и 800 мг ДГК, более высокая дозировка в 2400 мг ЭПК и 1600 ДГК (то есть в общем 4 г ЭПК и ДГК) приведет к более интенсивному снижению жировой массы. Чтобы получать такие дозы омега-3 кислот необходимо принимать концентрат рыбьего жира.
Список литературных источников доступен для авторизованных пользователей. Регистрация занимает всего 45 сек.
Авторизация Такой гормон как Адипонектин вырабатывается жировыми клетками людей. Он важен для профилактики сердечно-сосудистых и многих других заболеваний. Его маленькие дозы могут применяться для лечения хронических депрессий. При ожирении его количество и активность в крови понижается. Его рекомендуют применять при ожирении и диабете. Попадая в мышечную ткань, адипонектин способствует окислению жирных кислот, улучшает ее чувствительность к инсулину. Проведенные с ним эксперименты показали, что он имеет выраженные антиатерогенные и противовоспалительные эффекты. Повышение содержания гормона адипонектина в организме человека всегда способствует излечению такого заболевания как диабет.
Такой гормон как Адипонектин вырабатывается жировыми клетками людей. Он важен для профилактики сердечно-сосудистых и многих других заболеваний. Его маленькие дозы могут применяться для лечения хронических депрессий. При ожирении его количество и активность в крови понижается. Его рекомендуют применять при ожирении и диабете. Попадая в мышечную ткань, адипонектин способствует окислению жирных кислот, улучшает ее чувствительность к инсулину. Проведенные с ним эксперименты показали, что он имеет выраженные антиатерогенные и противовоспалительные эффекты. Повышение содержания гормона адипонектина в организме человека всегда способствует излечению такого заболевания как диабет.
Повышение в организме количества адипонектина многие связывают с высокой чувствительностью человека к инсулину. Такое состояние приводит к деменции, а также к возникновению болезни Альцгеймера у многих женщин. Поскольку гормон производится из висцеральных жиров, он принимает участие в регулировании метаболизма такого вещества как глюкоза, а также липида. Такой вывод ученые сделали исходя из того, что практически любые вещества, повышающее чувствительность к инсулину, имеют противовоспалительные свойства. Согласно выработанной теории они должны снижать риски образования деменции.
Авторы этих работ, работающие в Human Nutrition, поведали об этом исследовании в электронном издании Архивы неврологии. Подача сигнала о количестве инсулина в мозге у людей, имеющих заболевание Альцгеймера, как правило, нарушена. Адипонектин значительно увеличивает чувствительность людей к инсулину, поэтому исследователи ждут положительную реакцию на когнитивные функции. Но адипонектин наоборот только повышает возможные риски возникновения Альцгеймера и деменеции.
Повышение уровня содержания адипонектина по данным ученых способствовало развитию деменеции и болезни Альцгеймера. Так, по данным проведенных тестов, 159 женщин из 542, участвовавшей в них, получили развитие деменции, а 125 из них заболели Альцгеймером. По данным этого исследования следует, что число образования деменеции уже на протяжении последующих двадцати лет увеличится в два раза и достигнет 72 миллионов человек во всем мире.
Этот гормон кодируется геном ADIPOQ, он еще имеет название гормон голодания. Его относят к гормону белковой природы. Этот гормон был открыт сравнительно недавно в 1996 году Шерером. Он также влияет на обмен веществ и на окисление жирных кислот. Когда происходит снижения уровня данного гормона в организме, то начинается процесс отложения липидов в тканях сердца, печени. Такие процессы могут вызывать разного рода патологии. Уровень этого гормона является отличным показателем риска развития болезней сердца, рака, диабета.
ADIPOQ против воспаления стенки сосудовБелок Адипонектин циркулирует в крови человека, имея вид крупного комплекса, он служит базовым белком в ней и протекает через жировые ткани. Ученые собираются детально изучить все механизмы влияния этого гормона на клетки и сосуды, которые находятся под воздействием большой концентрации глюкозы, в условии близком к состоянию организма человека при диабете. Повышенный уровень глюкозы вызывает развитие воспалительных изменений стенок сосудов. По мнению авторов этих исследований, адипонектин может предотвращать эти изменения и восстанавливать уже образовавшиеся ранее дефекты.
Продолжительность жизни и адипонектинАдипонектин и соматотропный гормон, по мнению многих ученых, играет немало важную роль в продолжительности жизни, он влияет и на состояние здоровья пожилых. Это мнение участников конгресса нейроэндокринологов прошедшего в Питтсбурге. В проведенном ими исследовании приняли участие женщины старше 102 лет, их было 25. Их хорошее состояние и такую продолжительность жизни исследователи связали с высоким уровнем содержания гормона Адипонектина.
Решив применять гормоны нужно помнить, что их влияние на организм человека, побочные эффекты еще мало изучены и не понятны, особенно при длительном их использовании. Многие ученые пока еще не рассматривают процесс старения как болезнь и не доверяют препаратам, о которых считается, что они смягчают негативные последствия этих сложных и непонятных до конца процессов.
Ожирение является одной из важных проблем здравоохранения во многих странах мира. Это связано с его большой распространенностью, высокими темпами роста численности больных, развитием у них множественных осложнений, ранней инвалидизацией и сокращением продолжительности их жизни. По мере изучения патогенетических особенностей основных заболеваний, ассоциированных с ожирением, установлена тесная взаимосвязь увеличенной массы тела (МТ) с нарушениями практически во всех органах и тканях: жировая дистрофия печени, миокардиодистрофия, патология почек, артрозы, артериальная гипертония, на рушение толерантности к углеводам и др. [1-3]. Многие метаболические и сосудистые нарушения, ассоциированные с ожирением, объединены в понятие "метаболический синдром" (МС) и сопряжены с высокой сердечно-сосудистой смертностью. Все это позволяет рассматривать ожирение как тяжелое хроническое заболевание, требующее активного лечения.
В основе развития МС лежит целая группа факторов риска атеросклероза, прежде всего, висцеральное ожирение, инсулинорезистентность (ИР), дислипопро-теинемия, гипергликемия, артериальная гипертония, которые тесно коррелируют с гиперсекрецией инсулина [4-5]. По мнению многочисленных исследователей, гиперинсулинемия напрямую связана с ИР и нарушением утилизации глюкозы периферическими тканями [1, 2, 5, 6] Есть данные, свидетельствующие о наличии прямой связи между снижением чувствительности к инсулину и резистентностью к лептину [7-9]. При ожирении установлена способность лептина нарушать связывание инсулина со специфическими рецепторами в адипоцитах [5], а также взаимосвязь между уровнем лептина крови и концентрацией инсулина и глюкозы в крови. Долгое время адипоциты рассматривали как относительно инертное, статистическое энергетическое депо. В последние годы жировая ткань (ЖТ) признана активным эндокринным и паракринным органом [10]. Установлено, что адипоциты секретируют гормоны и цитокины, которые осуществляют как центральную регуляцию энергетического обмена (лептин), так и периферическое воздействие на чувствительность тканей к инсулину (резистин, адипонектин, белок, стимулирующий ацитилирование и др.). Кроме того, адипоциты, реагируя на сигналы циркулирующих гормонов, участвуют в липогенезе, липолизе и термогене-зе. Адипокины, вырабатываемые ЖТ, оказывают разнообразные биологические эффекты на сосудистую стенку и могут влиять на активность метаболических процессов в различных органах и тканях.
Учитывая, что ожирение является мощным, независимым фактором развития ИР и лежит в основе МС, методы лечения должны быть направлены на уменьшение массы ЖТ и повышение чувствительности тканей к инсулину. Очевидно, что такая тактика оправдана не только для лечения ожирения, но и для коррекции гемодинамических и метаболических параметров [11, 12]. Немедикаментозные подходы к снижению МТ, включающие уменьшение калорийности питания и увеличение физической активности, остаются основами ее контроля. Однако успех этих мероприятий ограничен, что определяет необходимость присоединения медикаментозных способов коррекции МТ, в первую очередь, у больных сахарным диабетом (СД) 2-го типа. В ряду препаратов, способствующих снижению МТ, особое место принадлежит Ксеникалу, который ингибирует желудочно-кишечные липазы и не дает нежелательных системных эффектов.
Цель настоящей работы — оценить изменение кли-нико-лабораторных показателей у больных СД 2-го типа в сочетании с ожирением при снижении МТ.
Материалы и методы
В открытое контролируемое рандомизированное исследование длительностью 6 мес включили 75 пациентов (62 женщины, 13 мужчин) с СД 2-го типа и ожирением. Возраст больных в среднем по группе составил 53 ± 0,87 года, масса тела (МТ) — 104 ± 2,41 кг, средняя длительность СД 2-го типа — 5,34 ± 0,63 года. Перед включением в исследование все пациенты проходили курс обучения в школе для больных с избыточной МТ, в рамках которого получали необходимые знания о рациональном питании и физических нагрузках. Пациенты получали сахароснижающую терапию по различным схемам (препараты сульфонилмочевины, бигуаниды, инсулинотерапию). Всем отобранным для лечения пациентам были рекомендованы умеренно гипокалорийное питание с содержанием жира не более 30% от калорийности суточного рациона и увеличение физической активности. После выполнения предусмотренных протоколом исследований все больные были рандомизированы на 2 группы. Больные 1-й группы (n = 55) в сочетании с умеренно гипокалорийной диетой получали Ксеникал по 1 капсуле (120 мг) 3 раза в день с каждым основным приемом пищи, больные 2-й группы (n = 20) — только умеренно гипокалорийную диету. В динамике ежемесячно контролировали МТ, ИМТ, окружность талии (ОТ), бедер (ОБ), ОТ/ОБ. Дважды за период наблюдения (в начале и после 6 мес лечения) определяли содержание жировой и тощей массы с помощью рентгеновской двухфотонной абсорбциометрии DEXA. Производили взятие венозной крови для определения основных параметров жирового и углеводного обменов.
Степень компенсации углеводного обмена оценивали по уровню гликированного гемоглобина (HbAlc) и уровню глюкозы в крови натощак. HbAlc определяли на автоматическом анализаторе DiasSTAT (Bio-Rad, США). Глюкозу в сыворотке крови определяли используя набор GLUCOSE "E-D" (Витал Диагностик, Россия). Иммунореактивный инсулин (ИРИ) измеряли набором INSULIN (DSL-10-1600) с использованием принципа ИФА. За нормальные уровни ИРИ натощак приняты показатели менее 30 мкМЕ/мл.
Состояние жирового обмена оценивали путем определения различных фракций липидов на биохимических анализаторах Eos-Bravo (Италия) и Stat Fax (США) с использованием реактивов фирмы Витал Диагностик, Россия.
Адипонектин измеряли набором Human Adiponectin ELISA Kit (B-Bridge International, Inc). За нормальные уровни адипонектина были приняты показатели не ниже 10,3 мкг/мл. Для исследования лептина использовали ИФА-набор HUMAN LEPTIN ELISA (DSL-10-23100) с заданным нормальным уровнем до 25 нг/мл, а-фактор некроза опухоли (а-ФНО) измеряли с помощью диагностического набора CYTELISA Human TNA-a Cytimmune, с использованием принципа ИФА, с заданным нормальным уровнем цитокина 0-50 пг/мл.
Обработку полученных данных проводили с помощью пакета программ Statistic 6,0 и Microsoft Exell 2000 for Windows. В случае распределения, близкого к нормальному, количественные показатели представляли в виде средних значений (М) ± стандартная ошибка средней величины (SE). Статистическую достоверность изменений параметров эффективности к 6-му месяцу лечения рассчитывали для количественных переменных с использованием парного t-теста Стьюдента и знакового критерия Вилкоксона. Достоверность различий между группами оценивали с помощью критерия Манна— Уитни.
При комплексном клинико-лабораторном обследовании все пациенты имели признаки МС (ИР в сочетании с СД 2-го типа, признаки абдоминального ожирения, дислипидемию по атерогенному типу) и характеризовались отсутствием компенсации СД 2-го типа (табл. 1).


При исследовании секреторной активности ЖТ и уровня ИРИ установили:
• гиперлептинемию — у 98% больных (средняя концентрация лептина у женщин 64,90 ± 5,96 нг/мл при норме 4,1-25 нг/мл, а у мужчин 68,82 ± 21,76 нг/мл при норме 1,2-9,5 нг/мл), что свидетельствует о выраженной лептинорезистентности у больных с ожирением;
• гипоадипонектинемию — у 92% больных (средний показатель уровня адипонектина у мужчин 4,68 ± 0,45 мкг/мл при норме 1,0-10,5 мкг/мл; у женщин 6,33 ± 0,37 мкг/мл при норме 10,3-14,5 мкг/мл), что вносит существенный вклад в развитие ИР и сердечно-сосудистых осложнений;
• повышение уровня а-ФНО — у 65% (средний уровень а-ФНО составил 110,38 ± 10,52 пг/мл при норме 0-50 пг/мл), который рассматривается как медиатор ИР и хронического воспаления;
• гиперинсулинемию натощак — у 76% больных (средний уровень базального инсулина был 47,16 ± 3,36 мкМЕ/мл). У 100% больных— повышение индекса ИР — НОМА (средний показатель составил 11,43 ± 0,89 при норме до 2,77), что свидетельствует о выраженной ИР.
Таким образом, у включенных в исследование пациентов наряду с признаками МС имелись выраженные изменения секреторной активности ЖТ и ИР, что способствует быстрому прогрессированию СД 2-го типа, его осложнений и атеросклероза у данной категории пациентов.
При проведении корреляционного анализа по Спирмену мы выявили, что уровень лептина имел положительную статистически значимую корреляционную связь с МТ (r = 0,39; р < 0,001), ОТ (r = 0,39; р < 0,0001), но в большей степени он соотносится с ИМТ (r = 0,57; р < 0,00001) и процентным содержанием ЖТ (r = 0,54: р < 0,0001). Наличие более тесной корреляции с массой ЖТ может быть связано с гипер-лептинемией, что вторично повлекло за собой нарастание МТ и увеличение ОТ.
Уровень адипонектина имел отрицательную статистически значимую корреляцию с ОТ/ОБ (r = -0,41; р < 0,001). Мы выявили отрицательную связь уровня адипонектина с уровнями атерогенных липидов сыворотки крови — уровнем триглицеридов (r = -0,25; р < 0,05), и с уровнем ХС ЛПОНП (r = -0,24; р < 0,05) и положительную связь с уровнем антиатеро-генных липопротеидов — ХС ЛПВП (r = 0,47; р < 0,001). Отмечена отрицательная связь уровня ади-понектина с индексом атерогенности (4,3 ± 0,18; r = -0,44; р < 0,0001), отражающим отношение уровней ХС атерогенных липопротеидов и ХС антиатеро-генных липопротеидов. Указанные изменения доказывают, что снижение плазменного адипонектина может играть важную роль в развитии атеросклеротических поражений сосудов. Мы показали, что адипонектин имеет более тесные корреляционные связи с гиперин-сулинемией (r = -0,39; р < 0,001) и ИР (rs = -0,32; р < 0,005), чем с ИМТ и массой ЖТ. Тот факт, что низкий уровень адипонектина ассоциируется с атероген-ным липидным профилем и ИР, позволяет рассматривать адипонектин в качестве одного из маркеров МС.
С увеличением ИМТ увеличивались уровни лепти-на, ИРИ и индекс ИР НОМА, причем эта зависимость носила нелинейный характер, то есть имелась тенденция к повышению уровня ИРИ, лептина и индекса ИР НОМА при увеличении ИМТ, однако крайне высокая степень ожирения (ИМТ более 45 кг/м2) сопровождалась стабилизацией уровня лептина и индекса ИР НОМА. Мы не установили статистически значимой корреляции уровней а-ФНО с уровнями других адипо-кинов и ИРИ. Однако была отмечена тенденция к увеличению уровня а-ФНО с увеличением уровня лепти-на, которая не достигла уровня статистической значимости.
Динамика антропометрических показателей.
После 24 нед активного лечения 87% пациентов 1-й группы достигли клинически значимого снижения МТ (>5% от исходной). Кроме того, у 6,25% МТ снизилась на 10% и более. Во 2-й группе уменьшение МТ на 5% от исходной отмечено у 70% пациентов. В 1-й группе МТ снизилась с 106,81 ± 2,93 до 101,41 ± 2,72 (р < 0,0001), что составило 4,76 ± 0,45% от исходного, а во 2-й группе — с 96,3 ± 3,68 до 92,6 ± 4,04 кг (р < 0,01), что составило 3,84 ± 0,8% от исходной (табл. 2). Таким образом, МТ и ИМТ достоверно снизились в обеих группах, однако более выраженная динамика этих показателей отмечалась у больных, получавших Ксеникал в сочетании с умеренно гипокало-рийной диетой. Снижение МТ в 1-й группе сопровождалось уменьшением выраженности абдоминального ожирения, о чем свидетельствовало снижение ОТ с 117,96 ± 1,84 до 111,40 ± 1,85 см и ОТ/ОБ с 0,96 ± 0,01 до 0,89 ± 0,03 (р < 0,05). Улучшение антропометрических показателей сопровождалось изменением процентного соотношения жировой и тощей МТ, в 1-й группе пациенты худели в основном за счет потери жировой МТ, тогда как пациенты из 2-й группы — в большей степени за счет потери тощей МТ (табл. 3).

Динамика показателей липидного и углеводного обмена. Снижение МТ и массы ЖТ оказывало положительное влияние на липидный спектр крови и на степень компенсации СД. В 1-й группе перераспределение содержания липопротеидов характеризовалось снижением уровня ХС атерогенных и повышением антиатерогенных фракций, что вело к снижению индекса атерогенности, во 2-й группе эта динамика не достигла уровня статистической значимости (табл. 4).
Лечение Ксеникалом сопровождалось улучшением показателей углеводного обмена: снижение уровня гликемии натощак в 1-й группе было большим, чем во 2-й группе: с 9,62 ± 0,39 до 8,34 ± 0,38 ммоль/л, (А — 1,3 ± 0,37 ммоль/л р < 0,001) и с 8,61 ± 0,38 до 8,01 ± 0,93 ммоль/л (А 0,60 ± 0,81 ммоль/л р = 0,06) соответственно. Та же тенденция отмечена и в отношении уровня HbAlc: в 1-й группе он снизился 7,90 ± 0,18 до 7,20 ± 0,16 % (А 0,78%, р < 0,001), а во 2-й — с 7,54 ± 0,40 до 6,85 ± 0,40 % (А 0,69%, р = 0,06). Наиболее выраженное снижение гликемии натощак наблюдалось у больных, получавших метформин наряду с Ксеника-лом (А гликемии натощак составила 2,56 ммоль/л, р = 0,001), что сочеталось с наибольшей потерей жировой МТ и снижением степени ИР. По динамике HbAlc наибольший эффект отмечался у пациентов, получавших метформин (А 0,91%, р < 0,05) и инсули-нотерапию (А 1,04%, р < 0,005), что, по-видимому, также связано с выраженностью ИР у этих больных (табл. 5).

Динамика ИРИ и индекса ИР НОМА. При сравнительном анализе выявлены статистически достоверные различия в изменении ИРИ и индекса ИР НОМА между 1-й и 2-й группами. Уровень ИРИ натощак в 1-й группе больных снизился на 8,97 ± 1,88 мкМЕ/мл, а во 2-й группе повысился на 1,16 ± 1,62 мкМЕ/мл (р < 0,01). Уменьшение уровня ИРИ параллельно со снижением гликемий позволяет говорить о достоверном снижении ИР тканей, что отражалось на показателе ИР НОМА (в 1-й группе снизился на 42%, а во 2-й группе повысился на 6%).
На фоне снижения МТ и улучшения метаболических показателей у больных 1-й группы отмечалось уменьшение потребности в сахароснижающих препаратах у 18% пациентов и антигипертензивных препаратах у 10% пациентов. У 6% больных в результате лечения сахароснижающие препараты были отменены.
Динамика показателей гормональной активности ЖТ. Снижение МТ существенно повлияло на секреторную активность жировой ткани и динамику уровней основных адипокинов (табл. 6). Снижение МТ и массы ЖТ приводило к значительному снижению уровней лептина, ИРИ и а-ФНО, что, в конечном счете, способствовало улучшению метаболических процессов. Важно отметить, что значительное уменьшение МТ также положительно сказывалось на уровне адипонектина, который несколько повысился после 24 нед лечения в обеих группах пациентов.
При сравнительном (между группами) анализе динамики адипокинов и ИРИ статистически достоверные различия были получены только по изменению ИРИ и показателя ИР НОМА (в 1-й группе ИРИ снизился на 8,97 ± 1,88 мкМЕ/мл, а во 2-й группе повысился на 1,16 ± 1,62 мкМЕ/мл; р < 0,01). Уменьшение уровней ИРИ параллельно со снижением гликемии свидетельствует о снижении ИР тканей, что отражает индекс ИР НОМА. При лечении Ксеникалом статистически достоверно увеличится процент больных с нормальной чувствительностью к инсулину, в то время как во 2-й группе это не отмечалось.
В 1-й группе нежелательные побочные явления были слабо выражены, отмечались лишь в начале лечение (у 15 пациентов), имели преходящий характер и не послужили причиной выхода из исследования. Их выраженность и продолжительность напрямую зависели от соблюдения больными рекомендаций по ограничению жиров в рационе питания. Побочное влияние Ксеникала на ЖКТ было дополнительным фактором, мотивирующим пациентов следовать рекомендациям по питанию.
Наряду с клиническими признаками МС у включенных в исследование больных СД 2-го типа и ожирением имелись выраженные изменения секреторной активности ЖТ, что, по-видимому, создает дополнительные трудности в снижении МТ и способствует более быстрому развитию атеросклероза у этой категории пациентов. По литературным данным, пациенты с ожирением характеризуются более высоким уровнем лептина, чем лица с нормальной МТ [6, 9, 13, 14]. Наши данные согласуются с данными других исследований: гиперлептинемия была выявлена у 98% больных. У находившихся под наблюдением пациентов, гипер-лептинемия отмечалась наряду с высоким уровнем инсулина, что позволяет предполагать, что гиперлеп-тинемия у этих больных, как и гиперинсулинемия, обусловлены ИР. Установлены положительные корреляции между уровнем лептина и ИРИ натощак и индексом ИР НОМА, но не уровнем глюкозы крови натощак. Гиперлептинемия имела место на фоне ожирения, отражая периферическую лептинорезистентность, что свидетельствовало о нарушении регуляции энергетического баланса.
Важнейшую роль в метаболизме глюкозы и липи-дов играет адипонектин, который служит фактором риска развития ИР и атеросклеротического поражения сосудов. Гипоадипонектинемия выявляется часто у пациентов с СД 2-го типа, независимо от ИМТ, и доказана ее связь с тканевой ИР, повышением риска возникновения сердечно-сосудистой патологии. Ги-поадипонектинемия напрямую связана с ожирением и может служить дополнительным маркером ИР. Это состояние было выявлено у 92% обследованных пациентов.
Повышение уровня а-ФНО имело место у 65% больных, включенных в анализ, что указывает на роль этого адипокина в развитии выраженной ИР, это может быть предиктором ускоренного развития атеросклероза. Повышение уровня а-ФНО в 2 раза приводило к нарастанию уровней общего ХС, ХС ЛПНП, индекса атерогенности и сопровождалось возрастанием риска развития ишемической болезни сердца.
В связи с уменьшением массы ЖТ на фоне лечения отмечена тенденция к нормализации секреторной активности ЖТ, уровня ИРИ и индекса ИР НОМА. Снижение МТ на 4,76% сопровождалось уменьшением уровней лептина на 6,9%, а-ФНО на 80%, ИРИ на 42%, индекса ИР НОМА на 41% от исходных величин. Кроме того, имела место положительная динамика показателей углеводного и липидного обмена.
Как показали результаты исследования, применение Ксеникала воздействует на основные звенья патогенеза МС у больных СД 2-го типа, а именно на ожирение, ИР, дислипидемию. Такой подход особенно оправдан при СД 2-го типа, при котором, как правило, имеют место ожирение, гиперинсулинемия, гипергликемия, а также множественная сопутствующая патология. Дополнительное назначение Ксеникала позволяет уменьшить прием или даже отменить ряд лекарственных препаратов гипогликемизирующего, гипотензивного, гиполипидемического действия [11—15], что также отмечалось у наших больных. В дополнение к этому присоединение Ксеникала к комплексной терапии СД значительно улучшает течение и компенсацию этого заболевания.
1. Бутрова С. А. Дэгоева Ф. X. Висцеральное ожирение — ключевое звено метаболического синдрома. Ожирение и метаболизм 2004; 1: 10—16.
2. Бессесен Д. Г. Кушнер Р. Избыточный вес и ожирение. Профилактика, диагностика и лечение. М. "БИНОМ"; 2004.
3. Lustig R. H. Autonomic dysfunction of the рЗ-cell and the pathogenesis of obesity. Rev. Endocr. Metab. Disord. 2003; 4 (1): 23-32.
4. Бутрова С. А. Современная фармакотерапия ожирения Consilium Medi-cum 2004; 6 (9): 669—674.
5. Hotamasligil G. S. Molecular mechanism of insulin resistance and the role of the adipocyte. Int. J. Obes. 2000; 24 (suppl. 4): 23-27.
6. Prentice A. M, Obesity and its potential mechanistic basic. Br. J. Med. Bull. 2001; 60: 51-67.
7. Терещенко И. В. Эндокринная функция жировой ткани: Проблемы лечения ожирения. Клин. мед. 2002; 7: 9-14.
8. Giugliano G. Nicoletti G. Grella E. et al. Effect of liposuction on insulin resistance and vascular inflammatory markers in obese women. Br. J. Plast. Surg. 2004; 57: 190-194.
9. Fernandez R, Manue J. Vayreda M. et al. The fat-free mass compartment influences leptin in men. Eur. J. Endocrinol. 2000; 142: 25-29.
10. Funahashi T. Hypoadiponectinemia in obesity and type 2 diabetes: close association with insulin resistance and hyperin sulinemia. J. Clin Endocrinol. Metab. 2001; 86 (5): 257-263.
11. Miles J. M. Leiter L. et al. Effect of orlistat in overweight and obese patients with type 2 diabetes treated with metformin. Diabet Care 2002; 25: 11231128.
12. Kelley D. E, Bray G. A. Clinical efficacy of orlistat therapy in overweight and obese patients with insulin-treated type 2 diabetes. Diabet. Care 2002; 25: 1033-1041.
13. Shuldiner A. R. Rongze Y. Gong D. W. Resistin, obesity and insulin resistance — the emerging role if the adipocyte as an endocrine organ. N. Engl. J. Med. 2001; 345 (18): 1345-1346.
14. Tremblay A. Human obesity: a defect of lipid oxidation of in thermogenesis? Int. J. Obes. 1992; 16: 953-957.
15. Zimmet P. Etiology of the metabolic syndrom: potential role of insulin resistance, leptin resistance and other players. Ann. N. Y. Acad. Sci. 1999; 892: 25-44.